| French | English | Arabic |
| Enzyme | Enzyme | إنزيم |
| site actif | Active site | موقع نشيط |
| Purification de l'enzyme | Enzyme purification | تنقية الإنزيم |
الإنزيمات. تنقية وتطبيقات
Enzymes. Purification and applications
The purification of enzymes remains related to the separation and analytical techniques used. Thus, in about ten years, thanks to Affinity chromatography, the number of isolated enzymes increased from 1,300 in 1968 to more than 3,000 enzymes in 1992 and continued to increase with the emergence of new techniques for sorting enzymes.
تظل تنقية الإنزيمات مرتبطة بتقنيات الفصل والتحليل المستخدمة. هكذا، في حوالي عشر سنوات وبفضل كروماتوغرافيا الألفة (Affinity chromatography)، زاد عدد الإنزيمات المعزولة من 1300 في عام 1968 إلى أكثر من 3000 إنزيم في عام 1992 واستمر في الزيادة مع ظهور تقنيات جديدة لفرز إنزيمات كما يبينه الجدول التالي:
الانزيمات. تأثير تقنيات الفصل على التنقية والتوصيف
Enzymes. Effect of separation techniques on purification and characterization
(Payen & Persoz): ترسيب بواسطة الكحول. أول تحضير إنزيمي (مستخلص مائي من الشعير المنبت).
1923 (Svedberg & Nichols)استعمال أول طرد مركزي فائق السرعة
1926 (Sumner) تبلور اليورياز استظهارن البروتينية الطبيعة للإنزيمات.
1930. تم عزل حوالي 80 إنزيمًا
1935 (Adams & Holms)إدخال كروماتوغرافية التبادل الأيوني في تنقية الإنزيمات.
1938-1941 (Zechmeister & Brockman) استخدام كروماتوغرافيا الامتزاز.
1947: بدء استعمال الكروماتوغرافيا فوق الهلام و الكهرتهجير في عمليات تنقية الإنزيمات. أكثر من 200 إنزيم معزول.
1968 استعمال الترشيح فوق هلام السيفادكس والكهرتهجير. أكثر من 1300 إنزيم معزول.
1980 استعمال كروماتوغرفية الألفة في تنقية الإنزيمات. أكثر من 2000 إنزيم نقي.
1992: 3196 إنزيمًا نقيًا (Weeb, 1992 : EC enzyme nomenclature : recommandations of the Nomenclature Committee of the International Union of Biochemistry and Molecular Biology, San Diego, Ca, Academic Press).
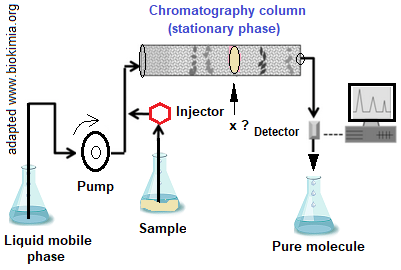
كما في حالة البروتينات، استخلاص وتنقية الأنزيمات عملية شاقة وطويلة ويعود ذلك إلى كون بعضها يرتبط ارتباطا وثيقا بأغشية عضيات الخلية مثل الغشاء البلازمي والميتوكندريا والشبكة الاندوبلازمية والبلاستيدات الخضراء. تبنى بروتوكولات (Protocoles) استخلاص وتنقية الأنزيمات على استغلال التمايز (الإختلاف) الموجود بين الجزيئات المستخلصة من ناحية الخصائص الفيزيائية والكيميائية. هكذا يمكن استغلال خاصية الحجم (الوزن) لفرز المواد بتقنية كروماتوغرافية الإقصاء (gel filtration chromatography)،المسماة كذلك ب 'الترشيح الغروي'. إستغلال خاصية التأين (Ionicity) أو الشحنة الكهربائية يستدعي استعمال تقنية كروماتوغرافية التبادل الأيوني (ion exchange chromatography) أو تقنية الكهرتهجير (electrophoresis).
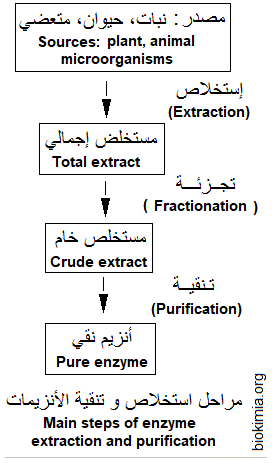
تدور مراحل استخلاص وتنقية الأنزيمات في وسط مبرد (حوالي + 4°C)، حتى يتم الحفاظ على البنى الوظيفية للأنزيمات (الثلاثية والرباعية). تبدأ الخطوة الأولى في استخلاص الإنزيمات بهرس وطحن النسيج الذي يحتوي على الإنزيم في محلول ذو خصائص معينة من pH وقوة إيونية ومواد أخرى، يتم اعتماده انطلاقا من معلومات مسبقة حول الأنزيم. يلي هذه المرحلة، القيام بالطرد المركزي لإزالة المواد غير الذائبة. يؤدي هذا إلى مستخلص أنزيمي يلقب ب 'مستخلص إجمالي' (Total extract)، يليه لاحقا 'المستخلص الخام' (Crude extract) الذي يضم الأنزيم مع بروتينات أخرى ثم 'الأنزيم النقي' (Pure enzyme)، كما يوضحه الشكل التالي.
في البداية، كثيرا ما كانت عملية تنقية الأنزيمات عملية طويلة تعتمد خاصة على اختلاف الذوبان (Solubility) في محاليل مختلفة للإنزيم موضوع الدراسة وللبروتينات الأخرى الخاملة والموجودة كملوثات في المستخلص. بعد 1926، سنة فصل أنزيم اليورياز (Urease) و عند 1930 لم يكن هناك إلا 30 أنزيما تمت تنقيتها. لكن في العقود الأخيرة سهلت تقنيات الكروماتوغرافيا والهجرة الكهربائية تنقية الإنزيمات إلى حد كبير، إذ تم تحضير ما يقارب 3200 إنزيما بشكل نقي أو شبه نقي عند سنة 1992. قبل مراحل التنقية بالكروماتوغرافيا، تجرى عمليات هامة تستغل فيها خاصية الذوبان كمعاملة المستخلص الإنزيمي بالملح، وذلك بإضافة ملح يحتوي على إيون ثنائي سالب الشحنة (على سبيل المثال كبريتات الامونيوم (Ammonium sulfate, (NH4)2SO4)) وينتج عن هذه العملية الترسيب لأن إيونات الالكتروليت (Electrolyte) تتحد مع الماء مما يقلل من كمية المحلول المتوفرة لذوبان البروتينات. تسمى هذه الطريقة ب 'الإفراجية بالملح' (Relargage par les sels). علما أن البروتينات والإنزيمات تترسب عند درجات مختلفة من التشبع بكبريتات الامونيوم، يتم استغلال هذه الخاصية لعزل البعض عن الآخر. من جهة أخرى، يؤدي تغيير الرقم الهيدروجيني (pH) لخليط من البروتينات إلى ترسيب تمايزى لأن ذائبية كل بروتين تكون أقل ما يمكن عند نقطة التعادل الكهربائي (Isoelectric point, pI). تسمى هذه الطريقة ب 'الترسيب عند ‘pI (Precipitation at pI). وهناك طريقة ثالثة عامة، كثيرا ما تستخدم للحصول على تنقية أولية وذلك بالاستفادة من اختلاف قابلية ذوبان البروتينات في محاليل مائية أضيفت اليها مقادير متفاوتة من محاليل عضوية ذائبة بالماء كالكحول الايثيلي (Ethanol) أو الأسيتون (Acetone). في الغالب تؤدي كل هذه العمليات إلى مستخلص يحتوي على أنزيم غير نقي بالكامل، يسمى المستخلص الخام (Crude extract).
بعد الحصول على مستخلص أنزيمي خام، يخضع هذا الأخير لتنقية الأنزيم باستعمال انواعا متعددة من أنظمة الكروماتوغرافيا والكهرتهجير. يمكن استخدام كروماتوغرافية التبادل الإيوني لفصل البروتينات الحامضية على مواد تبادل إيوني قاعدية مثل ثنائي إيثيل أمينو إيثيل سيليولوز (Diethylaminoethyl cellulose, DEAE-cellulose) الذي يعتبر من المبادلات الأنيونية (anion exchangers, -)، كما يمكن فصل البروتينات القاعدية على أعمدة تحتوي على طور ثابت (Stationary phase) يتكون من مبادلات سالبة الشحنة مثل كربوكسي ميثيل السيلولوز (Carboxymethylcellulose, CM-cellulose) الذي يدخل في خانة المبادلات الكاتيونية (cation exchangers, +). بالكروماتوغرافيا. من جهة أخرى، يمكن استعمال نوع آخر من الكروماتوغرافيا، مثل كروماتوغرافية الإقصاء، ليس فقط لفصل البروتينات (من بينها الأنزيم) المختلفة في أوزانها الجزيئية، بل وبعد معايرة العمود (باستخدام جزيئات ذات أوزان معروفة (محددات الأوزان الجزيئية، (Markers of molecular weight) يمكن التوصل إلى قيمة تقديرية للوزن الجزيئي الظاهري للأنزيم المراد تنقيته. من المواد الشائعة لتعبئة الاعمدة في كروماتوغرافية الإقصاء، نجد غرويات الدكستران (Dextran gels) المتشابكة (مثل حبيبات سيفادكس، Sephadex). وعند وجود عدة بروتينات ترافق الأنزيم فان الجزيئات الأكبر حجما تخرج من العمود في المرتبة الأولى، يليها تدريجيا نزول الجزيئات ذات الأوزان الصغيرة.
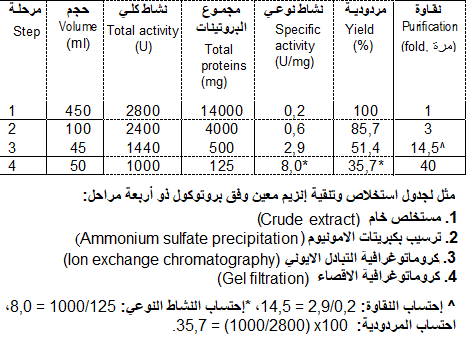
أثناء كل مرحلة من بروتوكول استخلاص و تنقية أنزيم ما، يقاس حجم المستخلص (ب مل، ml) و يتم تقدير نشاطه الإنزيمي بالوحدة الأنزيمية (Enzyme units, U) التي يعبر عنها بكمية الإنزيم التي تنتج سرعة معينة للتفاعل تحت الظروف المثلى (Optimal conditions). كما هو الحال بالنسبة للتفاعلات الكيميائية الاخرى، يمكن قياس سرعة التفاعل الإنزيمي بطريقتين:
- قياس نشاط الأنزيم بطريقة غير مستمرة (Discontinuous assay) حث يؤخذ جزء من خليط التفاعل على فترات زمنية محددة يوقف بعدها التفاعل وتفحص العينة على محتواها من مادة التفاعل (الركيزة) أو ناتج التفاعل اوكلاهما.
- قياس نشاط الأنزيم بطريقة مستمرة (Continuous assay) حيث تستغل بعض الصفات الفيزيائية والكميائية لمادة التفاعل او ناتج التفاعل، مثل امتصاص الضوء في موجة معينة، في الكشف عنها بدون أن يؤثر ذلك على سير التفاعل. هكذا يمكن مثلا تتبع تكوين NADH بواسطة المطياف الضوئي (Spectrophotometer) على طول موجي قدره 340 نانومتر. عموما، تستعمل طريقة القياس المستمر لأنها تضمن قياس السرعة الاولية (Initial velocity) الحقيقية للتفاعل. تعتمد سرعة التفاعل الإنزيمي على الظروف المثلى للتفاعل كدرجة الحرارة والأس الهيدروجيني (pH) واللذين يتوجب تثبيتهما أثناء التفاعل.
يحصل للإنزيمات مسخ (دنترة، denaturation) عند تعرضها للحرارة، إذ تفقد فعاليتها كليا عندما تسخن على 100 درجة مئوية لمدة 10 - 15 دقيقة. وللتعرف على فعالية الإنزيم في المستخلص الاجمالي أو الخام، ينصح بالكشف عن السرعة الاساسية للتفاعل بوجود المستحضر المسخن إلى درجة الغليان مقارنة بعدم وجود المستخلص الاجمالي أو الخام كليا. بهذه الطريقة، يكون من المحتمل الكشف فيما إذا كان المستخلص الاجمالي أو الخام يحتوي على مثبطات (Inhibitors) أو منشطات (Activators) ذات طابع غير بروتيني ومقاومة للحرارة في نفس الوقت. للتأكد من دقة تقييم النشاط الإنزيمي، يجب الحرص على أن السرعة الأولية للتفاعل تتناسب طرديا مع تركيز الإنزيم وأن سرعة التفاعل تتناسب طرديا مع الوقت (الحصول على خط مستقيم) خلال الفترة التي تؤخذ فيها العينات لوقف التفاعل، في حالة قياس نشاط الأنزيم بطريقة غير مستمرة. من جانب آخر يجب التأكد أن التركيزات المرتفعة لمادة التفاعل لا تثبط نشاط الأنزيم (تثبيط بفائض الركيزة) زيادة عن توفر وثبات الظروف المثلى لقياس نشاط الأنزيم (تركيزات مواد التفاعل، حرارة، pH).
أثناء استخلاص وتنقية الإنزيمات لا يمكن قياس كمية البروتين ذو الفعالية الإنزيمية في المستحضرات غير النقية، لكن بدلا من ذلك يعبر عن تركيز الإنزيم الموجود في التحضير بعدد الوحدات/مل (Units/ml). أما النشاط النوعي للإنزيم (specific activity) في التحضير فيعبر عنه بوحدات الإنزيم/مغ بروتين كلي (Units/mg)، أي أن الوحدة المستعملة للتعبير عن النشاط النوعي للإنزيم عبارة عن عدد مايكرو مولات ماد ة التفاعل المتحولة بالدقيقة لكل ملغم بروتين تحت الظروف المثلى والثابتة، من ودرجة الحرارة والأس الهيدروجيني (pH). يعطي النشاط النوعي للإنزيم مؤشرا على مدى نقاوة الإنزيم في مستحضر ما.
من خلال نتائج المراحل المتبعة في استخلاص وتنقية إنزيم معين، يتميز كل بروتوكول استعمل من أجل هذا الغرض، بجدول التنقية (Purification table) الذي يظهر مردودية (Yield) البروتوكول ودرجة نقاوة الأنزيم (Purification level). تعبر مردودية البروتوكول، على النسبة المئوية المتبقية من نشاط الأنزيم في المرحلة الأخيرة من التنقية، مقارنة بالمرحلة الأولى (100%). يشير معيار التنقية (purification level) إلى كم من مرة (x) نقي الأنزيم في في المرحلة الأخيرة من التنقية، مقارنة بالمرحلة الأولى (1 x)، علما أن نسبة التنقية عند مرحلة معينة تساوي القيمة الإجمالية لنشاط الأنزيم (بالوحدات) مقسومة على القيمة الإجمالية للبروتينات (بالملغرام) في نفس المرحلة. على صعيد المثل، نقول إن تطبيق بروتوكول معين في تنقية أنزيم معين يؤدي إلى أنزيم نقي 40 مرة بمردودية 35,5% (فقدان 64,5% من وحدات الأنزيم) (أنظر الجدول التالي).
تمارين في موضوع تنقية الإنزيمات

Share this information on social media تبادل المعلومة عبر المواقع الإجتماعية
 |
 |
 |
 |
 |
Enzymes. Applications
عرف التحفيز البيولوجي عبر الأنزيمات العديد من التطبيقات المهمة في مختلف المجالات مما انعكس عنه النمو الاقتصادي والمحافظة عن البيئة وصحة المجتمعات. يستغل الإنسان الأنزيمات التي تحتوي عليها الكائنات الحية الدقيقة كالبكتريا والفطريات لاستعمالها في تطبيقات نفعية للإنسان وكمثل يجدر ذكره استعمال الأنزيمات في مجالات البيو تكنولوجيات البيضاء (استعمال الكائنات الحية لإنتاج مواد كيميائية مطلوبة) والبيوتكنولوجيات الصفراء أو بيوتكنولوجيات البيئة. كذلك تستعمل الإنزيمات في مجالات الكشف السريع والدقيق.
مثل 1. استعمال الإنزيمات في المستشعرات الحيوية. تطبيق في الكشف عن تحلون الدم
Use of enzymes in biosensors. Case of blood sugar test
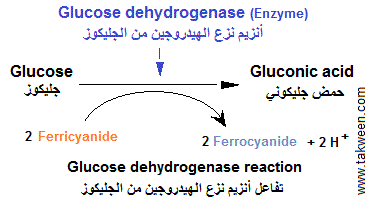
يمكن اختبار سكر الدم عن طريق تفاعل إنزيمي، لكن نادرًا ما تتبادل الإنزيمات الإلكترونات مع الأقطاب الكهربائية. لذلك، من الضروري استخدام وسيط (وسيط) يتحول من حالة مؤكسدة إلى حالة مختزلة بواسطة البروتونات التي تمت إزالتها من مختزل آخر، وهو جلوكوز الدم. كلما زاد وجود الوسيط المختزل (شدة تلوينه)، زاد وجود الجلوكوز.
يمكن تحفيز التفاعل الأنزيمي في ظل الظروف المثلى بواسطة إنزيم مثل الجلوكوز ديهيدروجينيز (Glucose dehydrogenase) مع وجود وسيط من نوع فيريسيانيد البوتاسيوم الذي سيختزل إلى فيروسيانيد البوتاسيوم بواسطة بروتونات H + الآتية من جلوكوز الدم (أنظر الرسم). هكدا كلما ارتفع لون الفيروسيانيد كلما كانت كمية السكر مرتفعة.

مثل 2. استخدام الإنزيمات في التحويلات اللأحيائية
Use of enzymes in bioconversions
تساهم الإنزيمات في التحويلات الأحيائية التي تعد جزءًا من البيو تكنولوجيات البيضاء (White biotechnology) التي تهدف إلى الإنتاج الصناعي. من بين التطبيقات التجارية للإنزيمات، يمكن ذكر إنتاج مساحيق الغسيل أو المنظفات. تجمع أهم ماركات الغسيل بين البروتياز والليباز والأميليز والسليولاز لهدف زيادة كفاءة الغسيل. كل من هذه الإنزيمات قادر على مهاجمة نوع معين من البقع أو التربة. مثال آخر في تطبيق الإنزيمات يتعلق بتصنيع شراب الفركتوز من النشا الذي يتم الحصول عليه من الذرة، حيث يلعب الأميلاز وإيزوميراز الجلوكوز دورًا رئيسيًا. من بين مزايا الإنزيمات قوة التفاعل، مقارنة بالتفاعلات غير المحفزة إذ أن الإنزيمات أسرع 10 مرات.
تشمل عيوب الإنزيمات التكلفة العالية، وقابلية الذوبان المحدودة في المذيبات والاعتماد على العوامل المساعدة الإنزيمات المساعدة، والخصوصية العالية للغاية، وعدم الاستقرار. يطمح استخدام الإنزيمات المجمدة (Immobilized enzymes) إلى القضاء على بعض عيوب التطبيق. إحدى مزايا الإنزيمات المجمدة يكمن في إمكانية إعادة استخدامها عدة مرات
فيديوهات - VIDEOS
Enzymes catalyseurs biologiques (version Ar)- الأنزيمات، محفزات بيولوجية'
 |
Page MOOC Enzymologie Approfondie |
روابط مفيدة - useful links
- إنزيمات. لائحة enzymes-enzymology-index
- الإنزيمات. البنيات الوظيفية والموقع النشيط
- Enzymes. Functional structures and active site
- إنزيمات. ميكانزمات التحفيز الإنزيمي
Enzymes. Catalysis mechanisms
- حركية الإنزيمات وفق ميكايليس-منت الثوابت Km و Vmax والتعبيرات المختلفة للنشاط الأنزيمين
Enzymes. Michaelis-Menten kinetics, Km and Vmax parameters and different expressions of enzymatic activity
- MECANISMES MOLECULAIRES DE LA CATALYSE BIOLOGIQUE ET IMPORTANCE DU SITE ACTIF DES ENZYMES
- CATALYSIS. MOLECULAR INTERACTION ENZYME-SUBSTRATE.
- ALLOSTERIC ENZYMES
- Enzymologie-enzymes (exercices)
- Purification des Protéines. Exercices
- QCM-Enzymes. Structure et fonction (bases)
--- ENZYMES. CATALYSEURS BIOLOGIQUES
PASSER UN CONTROLE QCM SUR LES ENZYMES (THEORIE + PRATIQUE)

Protéines, Acides aminés, Enzymes,.., livre 'Sciences de la vie. Protéines et Enzymes', Baaziz 2013
306 pages, 2013, ISBN : 978-99-54-32-663-3 + DVD mis à jour 2018 + Assistance
Afin d'encourager les illustrations vidéos des cours et données en biochimie, faite acquisition des livres de la préparation de la transition Secondaire-Supérieur et trouver toutes les vidéos sur les DVD accompagnant les ouvrages.
- تحميل ملفات في مواضيع البيوكيمياء
Téléchargement de fichiers en Biochimie

