الإنزيمات. البنيات الوظيفية والموقع النشيط
Enzymes. Functional structures and active site

| Arabic | French | English |
| أنزيم، موقع نشيط، تحفيز بيولوجي | Enzyme, site actif, catalyse biologique | Enzyme, active site, biological catalysis |
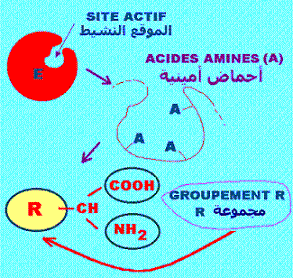
تظل وظيفة الإنزيمات (enzymes) مرتبطة بالبنية الثلاثية (أو ثلاثية الأبعاد أو التشكل) التي تهم طي البروتين الإنزيمي وهي بنية ضرورية في التحفيز إذ تسمح بتكوين الموقع النشيط (Active site) عن طريق الجمع بين الأحماض الأمينية (aminoacids) المكونة للموقع (مثل AA 57 ، AA195 ، AA220).
تلعب البنية الثلاثية للإنزيمات دورًا في حماية الموقع النشيط. أظهر حيود الأشعة السينية أن التنظيم ثلاثي الأبعاد للموقع النشيط للإنزيمات يختلف تمامًا في حالات غياب أو وجود الركيزة (Substrate). هكذا ظهرت النظرية المعروفة باسم "التشكل المستحث" (الملائمة المستحثة) حيث يُنظر إلى الموقع النشط على أنه "كيان مرن" من خلال التكيف تمامًا مع تشكيل الركيزة. تكمن البراهين التجريبية الداعمة لهذه النظرية في التغيرات في أطياف الامتصاص والفلورة لبعض الإنزيمات بوجود أو بعدم وجود ركائز.
تتمثل البنية الرباعية بارتباط الإنزيم بوحدات فرعية (Subunits) تعطي التعديلات التكميلية النهائية لضمان وظيفة الإنزيم. تؤدي هذه البنية إلى مفهوم الأشباه الإنزيمية (isozymes) التي تعد أشكالا من نفس الإنزيم الذي يحفز نفس التفاعل ، ولكن تختلف خصائصها الفيزيائية والكيميائية (الشحنة الكهربائية والحجم وما إلى ذلك). يتم استظهار الأشباه الإنزيمية بواسطة تقنية الكهرتهجير (Electrophoresis). يعد اللاكتات ديهيدروجينيز (LDH) أحد أفضل الأمثلة المعروفة.
تستعمل الإنزيمات في مجال دراسة تنوع الموارد الوراثية الحيوانية والنباتية والميكروبية (التنوع الجيني). يتم استخدامها في علم الوراثة السكانية نظرًا لطابعها السائد (يمكن تمييز الهجين بسهولة عن الوالدين).
معرفة كيف يشتغل الإنزيم (محفز بيولوجي) يحيل على توضيح آلية ملامسته للركيزة (Substrate) من خلال موقع نشيط.
يتكون الموقع النشط من عدد قليل من الأحماض الأمينية.
تحتوي الأنزيمات على موقع فعال يسمى الموقع النشيط (Active site) يوافق تماما الجزيئ الذي يشتغل عليه
الأنزيم (الالركيزة أو مادة تشبهها) توافقا يشبه توافق القفل و المفتاح (Key-lock complementarity).
يعتبر الموقع النشيط للإنزيمات منطقة متميزة من الإنزيم تتفاعل مع الركائز. يتكون هذا الموقع من 4 أنواع من الأحماض الأمينية:
/ أحماض أمينية ملامسة ، 2 / أحماض أمينية مساعدة ، 3 / أحماض أمينية متعاونة و 4 / أحماض أمينية غير متعاونة.
المجموعات الوظيفية للشق R للأحماض الأمينية للموقع النشيط للإنزيمات هي التي تتدخل في التحفيز. هذه المجموعات قليلة. غالبًا ما تكون هذه البقايا SERYL أو ASPARTYL أو GLUTAMYL و CYSTEYL و HISTIDYL LYSYL وأحيانًا ARGINYL و TYROSYL. ترتبط قدرة الأحماض الأمينية في الموقع النشط للإنزيمات على المشاركة في التحفيز بقدرتها على نقل الإلكترونات (صفة النيوكليوفيلية) والبروتونات (القاعدة الحمضية المميزة وفقًا لـ Broensted).

تدخل مباشرة الأحماض الأمينية الملامسة (غالبا، 2-4) في التفاعل مع الركيزة.
يلعب طي (Folding) البروتين دورا رئيسيا في تشكيل الموقع النشيط للأنزيم، حيث يقرب
الأحماض الأمينية بعضها للبعض. كل هذا يظهر أن نشاط الأنزيمات لا يستدعي بالضرورة تدخل الطرف الأنزيمي بأكمله.
كمثل يجسد هذا الوضع نذكر أنزيم الليزوزيم (Lysozyme) الموجود بإفرازات الأنف و الدموع واللعاب.
يقوم الليزوزيم بحلمأة (Hydrolysis) الروابط الجلوكوزيدية (Glycosidic bonds) في السكريات الموجودة بجدار الخلايا البكتيرية. يتكون الأنزيم من 129 حمض أميني، يأخد بعد طي البروتين، شكل 'حبة قمح منتفخة'. تلعب البنية الثلاثية للأنزيم دورا هاما في تشكيل الموقع النشيط بتقريب الحمض الأميني Glu35 (الحمض الجلوتامي) من الحمض الأميني Asp52 (الحمض الأسبارتي) بمسافة 0,30 nm فقط و جعلهم يتفاعلا مع الركيزة (سكر NAG-NAM). يبين الرسم التالي هذه التفاصيل، كما يمكن استخراج معلومات أخرى بتحميل جزيئ الليزوزيم و دراسته ببرنامج Rastop أو JMOL..

سؤال 1 - Q1
إختر المعلومة الصحيحة - Choose the correct information
(!الإنزيمات ناقلات للجزيئات - Enzymes are carriers of molecules)(الإنزيمات محفزات - Enzymes are catalysts)
سؤال 2 - Q2
يستخدم التحفيز البيولوجي دائمًا بنيات من البروتين - Biological catalysis always engages protein structures
(!صحيح - Correct)(خطأ - False)
سؤال 3 - Q3
تتميز الإنزيمات دائما ببنية بروتينية - Enzymes always have a protein structure
(صحيح - Correct)(!خطأ - False)
سؤال 4 - Q4
يتم تعديل (أو تدمير) الإنزيمات بعد تفاعل تحول الركيزة إلى ناتج - Enzymes are modified (or destroyed) by the reaction of transformation of a substrate into a product
(!صحيح - Correct)(خطأ - False)
سؤال 5 - Q5
الموقع النشيط للإنزيمات محدد بالضرورة لركيزة واحدة - The active site of enzymes is necessarily specific for a single substrate
(!صحيح - Correct)(خطأ - False)
سؤال 6 - Q6
يتكون الموقع النشيط للإنزيمات من عدد قليل من الأحماض الأمينية التي يتم تجميعها عن طريق الطي - The active site of enzymes is made up of a few amino acids brought together by folding
(صحيح - Correct)(!خطأ - False)
سؤال 7 - Q7
يتم تثبيت الركيزة على الأحماض الأمينية للموقع النشيط للإنزيمات بواسطة روابط ضعيفة - The fixation of the substrate on the amino acids of the active site of the enzymes is carried out by weak bonds
(صحيح - Correct)(!خطأ - False)
 |
 |
 |
 |
 |
الجواب على السؤال 1:
إن دور الإنزيمات ليس نقل الجزيئات ولكن بدلاً من ذلك ، تحولالجزيئات إلى نواتج
Answer to Question 1:
THE ROLE OF ENZYMES IS NOT THE TRANSPORT OF MOLECULES, BUT RATHER THEIR TRANSFORMATION INTO PRODUCTS.
الإجابة على السؤال 2: يمكن أن يحفز الحمض النووي الريبي أيضًا تفاعلًا بيولوجيًا. مثال، الريبوزيم على مستوى الريبوسوم ، أثناء تخليق البروتين (الترجمة في السيتوبلازم)
RNA can also catalyze a biological reaction. Example of the ribozyme at the ribosome level, during protein synthesis (translation in the cytoplasm)
الإجابة على السؤال 3: الإنزيمات عبارة عن بروتينات دائمًا يمكن أن تشمل ، في حالات معينة ، عنصرًا آخر!
Answer to question 3: ENZYMES ARE ALWAYS PROTEINS THAT CAN INCLUDE, IN CERTAIN CASES, ANOTHER COMPONENT!
الإجابة على السؤال 4: لا يتم تعديل الإنزيم بالتفاعل. يتم تجديدها دائمًا لتلعب نفس الدور مرة أخرى!
Answer to question 4: AN ENZYME IS NOT MODIFIED BY THE REACTION. SHE IS ALWAYS REGENERATED TO PLAY THE SAME ROLE AGAIN!
الإجابة على السؤال 5: في حالات معينة ، يتفاعل الموقع النشط مع عدة ركائز أو ركائز زائفة!
Answer to question 5: IN CERTAIN CASES THE ACTIVE SITE REACTS WITH SEVERAL SUBSTRATES OR 'FALSE SUBSTRATES
الإجابة على السؤال 6: نعم. يتكون الموقع النشيط من الأحماض الأمينية المتقاربة من بعضها البعض !
Answer to question 6: YES. THE ACTIVE SITE IS MADE UP OF AMINO ACIDS CLOSE TOGETHER IN SPACE!
الإجابة على السؤال 7: تساهم الروابط الضعيفة في تكون المعقد إنزيم-ركيزة !
Answer to question 7: INVOLVED IN THE FORMATION OF THE ENZYME-SUBSTRATE COMPLEX!
VIDEOS
Enzymes catalyseurs biologiques (version Ar)- الأنزيمات، محفزات بيولوجية'
 |
Page MOOC Enzymologie Approfondie |
روابط مفيدة - useful links
- إنزيمات. لائحة enzymes-enzymology-index
- الإنزيمات. تنقية وتطبيقات - Enzymes. Purification and applications
- إنزيمات. ميكانزمات التحفيز الإنزيمي
Enzymes. Catalysis mechanisms
- حركية الإنزيمات وفق ميكايليس-منت الثوابت Km و Vmax والتعبيرات المختلفة للنشاط الأنزيمين
Enzymes. Michaelis-Menten kinetics, Km and Vmax parameters and different expressions of enzymatic activity
بيتا جلاكتوسيداز. الثوابت الحركية وتأثير المثبطات
beta-galactosidase. Kinetic parameters (Km, Vmax) and the effect of inhibitors
- MECANISMES MOLECULAIRES DE LA CATALYSE BIOLOGIQUE ET IMPORTANCE DU SITE ACTIF DES ENZYMES
- CATALYSE. INTERACTION MOLECULAIRE ENZYME-SUBSTRAT.
- CATALYSE. INTERACTIONS MOLECULAIRES ENZYME SUBSTRAT-
- Video how enzymes are working (pdb)
PASSER UN CONTROLE QCM SUR LES ENZYMES (THEORIE + PRATIQUE)

Afin d'encourager les illustrations vidéos des cours et données en biochimie, faite acquisition des livres de la préparation de la transition Secondaire-Supérieur et trouver toutes les vidéos sur les DVD accompagnant les ouvrages.
-
تحميل ملفات في مواضيع البيوكيمياء
Téléchargement de fichiers en Biochimie
