French
|
Arabic
|
English
|
| Enzymes
|
إنزيمات |
enzymes |
| Site actif |
موقع نشيط |
Active site |
| Triade catalytique |
ثلاثية تحفيزية |
Catalytic triad |
| Catalyse covalente |
تحفيز تساهمي |
Covalent catalysis |
الإنزيمات. ميكانزمات التحفيز
Enzymes. Catalysis mechanisms
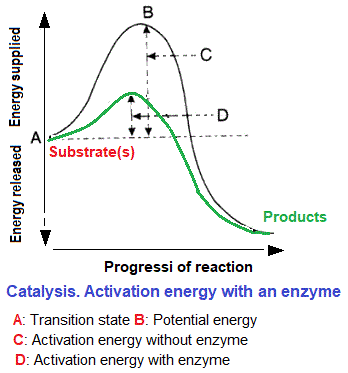
يتطلب التحفيز طاقة تنشيط كافية لتحويل الركيزة (الركائز) إلى منتجات. الإنزيمات (Enzymes) عبارة عن محفزات بيولوجية تقلل طاقة التنشيط اللازمة لحدوث التفاعل. ميكانزمات التحفيز (Catalysis mechanisms) عديد، نتطرق لها في هذه الصفحة
من أين تأتي الطاقة اللازمة لتقليل طاقة التنشيط للتفاعل الأنزيمي؟
تأتي الطاقة من التفاعلات الكيميائية بين الركيزة والمجموعات الوظيفية التي يحملها الإنزيم ، مثل السلاسل الجانبية للأحماض الأمينية والأيونات المعدنية والإنزيمات المساعدة. تزيد المجموعات الوظيفية للإنزيم من المعدل الأولي للتفاعل وتقليل طاقة التنشيط (باستخدام مسار تفاعل طاقة أقل). يأتي المصدر الثاني لإنتاج الطاقة اللازمة لخفض طاقة التنشيط من التفاعلات الضعيفة غير التساهمية بين الإنزيم والركيزة. وبالتالي ، تسهل الإنزيمات تكوين أنواع الحالة الانتقالية داخل التفاعل وتسريع معدل التفاعل بمقدار مليون مرة مقارنة بالتفاعلات غير المحفزة.
1. تحفيز إنزيمي حمضي-قاعدي
Enzymes. Acid-base catalysis
في الإنزيمات ، هناك ثلاثة أنواع رئيسية من الأحماض الأمينية تشارك في التحفيز الحمضي أو القاعدي. يمثلهم:
- الأطراف الحمضية الأسبارتات أو الجلوتامات التي يمكنها توفير بروتون عند درجة الحموضة 7.0 ،
- الأطراف القاعدية مثل Lysine أو Arginine التي تلتقط بروتونًا عند درجة الحموضة 7.0 و
- الهيستيدين والذي يمكن أن يعمل كأمفوتير.
معرفة الـ pK للسلاسل الجانبية لهذه الأحماض الأمينية ضرورية لفهم العديد من الآليات.
يشارك التحفيز الحمضي القاعدي في أي آلية تفاعل تتطلب نقل البروتون من جزيء إلى آخر. من الشائع جدًا رؤية هذه الآلية جنبًا إلى جنب مع التحفيز التساهمي (Covalent catalysis) حيث يتم تنشيط العديد من النيوكليوفيل عن طريق إزالة البروتون ، بما في ذلك المجموعات الوظيفية للكحول والثيول والأمين. يمكن تجميع الإنزيمات التي تستخدم التحفيز الحمضي القاعدي بشكل أكبر في تفاعلات حمض-قاعدة محددة أو تفاعلات حمض-قاعدة عامة. يحدث تحفيز حمضي محدد أو تحفيز قاعدي محدد إذا تم استخدام أيون الهيدرونيوم (H3O +) أو أيون الهيدروكسيد (OH-) ، على التوالي ، مباشرة في آلية التفاعل ، وكان الرقم الهيدروجيني للمحلول يؤثر على معدل التحفيز.
تحدث التفاعلات الحمضية والقاعدة العامة عندما تكون الجزيئات غير أيون الهيدرونيوم (H3O +) أو أيون الهيدروكسيد (OH-) مصدرًا للتبرع بالبروتون أو قبوله.

يعتبر التحفيز الحمضي القاعدي العام الآلية الأكثر شيوعًا في التحفيز الإنزيمي. ينتج تسريع التفاعل عن انتقال البروتون. يمكن أن يأتي هذا البروتون من زوج إيميدازول من سلسلة جانبية هيستيدين. يتأثر النشاط التحفيزي للأنزيمات من هذا النوع بدرجة كبيرة بالرقم الهيدروجيني (pH).
2. التحفيز التساهمي عند الإنزيمات
Enzymes. Covalent catalysis
الربط البسيط للركائز على الموقع النشط من خلال رابطة ضعيفة ( L. الهيدروجين، ...) لا يمكنها جلب الطاقات الكافية لتزويد جزيئات الركائز بطاقة التنشيط الكاملة للـ رد الفعل الأولي. يمكن توفير هذه الطاقة من خلال احتمالين أساسيين:
- تكوين روابط تساهمية إنزيم-ركيزة
- تكوين مجمعات وسيطة متتالية حيث يكون لكل خطوة طاقة تنشيط منخفضة نسبيًا.
يتعلق التحفيز التساهمي (التحفيز المحب للنووية) بشكل أساسي بالتفاعلات الأنزيمية مع العديد من الركائز (حوالي 20٪ من الإنزيمات وجميع الإنزيمات التي تحفز آلية مع ركيزتين من النوع ' بينغ-بونغ '). يتم نقل أثر الركيزة الأولى إلى الإنزيم عبر تشكيل رابطة تساهمية إنزيم-ركيزة (إنزيم عابر). ثم يتم نقل أثر الركيزة الأولى إلى الثانية.
الثالوث التحفيزي عند الإنزيمات
Enzymes. Catalytic triad
الطريقة الشائعة لإنتاج البقايا المحبة للنووية (Nucleophilic residues) من أجل التحفيز التساهمي (Covalent catalysis) هي من خلال ثالوث محب للنووية-حمض- قاعدة توفره ثلاثة أحماض أمينية تنتمي إلى الإنزيم كبروتين. تشكل هذه البقايا شبكة نقل الشحنة التي تستقطب وتنشط البقايا المحبة للنووية، والتي تهاجم الركيزة (Substrate) التي تشكل مع الإنزيم وسيطًا تساهميًا (Covalent intermediate) الدي يتم تحلله بعد ذلك لتحرير الإنزيم مرة أخرى.
بشكل عام، يمكن للثالوث التحفيزي أن يشير إلى أي مجموعة من ثلاث وحدات بنائية تعمل معًا وتشارك بشكل مباشر في التحفيز. نظرًا لأن الإنزيمات تطوى إلى أشكال معقدة ثلاثية الأبعاد، يمكن أن تكون بقايا الثالوث التحفيزي بعيدة عن بعضها البعض في البنية الأولية للإنزيم، ومع ذلك يتم تقريبها معًا في البنية الثلاثية البعد.
في الصورة التالية لبروتياز فيروس حرق التبغ (TEV protease)، الحمض يمثلة الحمض الأسبارتي (Acid = aspartic acid)، القاعدة يمثلها الهيستيدين (base = Histidine) والمحب للنووية يمثله السيستيين (Nuc = Cysteine)

In enzyme catalysis, the catalytic triad refers to the three amino acid residues of the active site that function together and are directly involved in catalysis. The enzymes concerned may be certain hydrolases and transferases such as peptidases, amidases, esterases, lipases and β-lactamases.
An acid–base–nucleophile triad produces nucleophilic residues for covalent catalysis. Catalytic triad for certain protease enzymes involves serine (S), aspartate (D) and histidine (H). The three amino acids work together to break peptide bonds on polypeptides. Because enzymes fold into complex three-dimensional shapes, the residues of a catalytic triad can be far from each other in the primary structure. However, they are brought close together in the tertiary structure (3D structure).
العناصر المكونة للثالوث التحفيزي
- محبي النووية : محبي النووية الأنزيمية الرئيسية هي الهيدروكسيل OH لمجموعة الكحول من السيرين والسلفهيدريل SH من مجموعة thiol أو S - أيون ثيولات السيستين. إن تضمين هذه العناصر المحبة للنووية (نيوكليوفيلات) في ثالوث محفز يزيد من نشاطها.
- القاعدة : تشتمل الثالوثات التحفيزية على قاعدة تقوم بقطبية محب النووية وتزيله البروتون من أجل زيادة تفاعله، لأنه لا يوجد حمض أميني طبيعي محب للنووية بدرجة كافية لتحفيز التفاعلات الكيميائية بمفردها. بشكل عام ، تلعب بقايا الهيستيدين الدور الأساسي في الثالوثات التحفيزية
- الحمض : تُستخدم بقايا الحمض في قطبية البقايا القاعدية. يشمل الحمض بشكل عام بقايا الأسبارتات أو الجلوتامات. قد تقتصر بعض الإنزيمات فقط على "ثنائية محفزة" (عوض الثلاثية)، عندما لا يكون المكون الحمضي ضروريًا لتحفيز بعض بروتينات السيستيين.
أمثلة على الثلاثيات التحفيزية (بترتيب nucleophile-base-acid):
- ثالوث Ser-His-Asp في كيموتربسين
- ثالوث Cys-His-Asp في بروتياز السيستين
- ثالوث Ser-His-His في بيبتيداز الفيروس المضخم للخلايا (Cytomegalovirus)

يُطلق على التحفيز التساهمي أيضًا التحفيز محب النووية :
- ينطوي على رفع السرعة عن طريق التكوين الظرفي لـ رابطة تساهمية بين الإنزيم وواحدة أو أكثر من الركائز.
- يصبح الإنزيم المعدل بعد ذلك متفاعلًا قبل العودة إلى حالته الأصلية عند نهاية التفاعل.
التحفيز التساهمي يتعلق بشكل أساسي بـ الإنزيمات الناقلة (Transferases) . البقايا الأكثر تداولا هي:
- مجموعة إيميدازولللهيستيدين (His) ،
- مجموعة ثيول من السيستايين (Cys) ،
- مجموعة الهيدروكسيل للسيرين (Ser).
الكيموتريبسين. مثال للميكانزمات التحفيزية المبنيةعلى كلٍ من التحفيز حمض-قاعدة و التحفيز التساهمي
chymotrypsin. An example of catalytic mechanisms based on both acid-base catalysis and covalent catalysis
الكيموتريبسين هو بروتياز يحفز تكسير رابطة الببتيد مع تفضيل الأحماض الأمينية Tyr و trp و Phe و Leu ( أحماض أمينية كارهة للماء). إنه جزء من عائلة سيرين بروتياز ، التي لها موقع نشط مماثل (تجويف كاره للماء). يتم تخليقه في شكل غير نشط من قبل البنكرياس. ثم ينتج الشكل النشط في الأمعاء الدقيقة.
يتكون الثالوث التحفيزي لبروتياز السيرين من الأسبارتات 102 (D102) كحمض والهيستيدين 57 (H57) كقاعدة والسيرين 195 (S195) باعتباره نيوكليوفيلا.
التحلل المائي للركائز النموذجية بواسطة الكيموتريبسين تحفيزًا حمضيًا قاعديًا بواسطة بقايا إيميدازول.
إنشاء وسيط تساهمي إنزيم-أسيل: الكيموتربسين (بروتياز) كمثل :
يحدث التفاعل المحفز بواسطة الكيموتريبسين على مرحلتين ، الأسيلة (Acylation) ونزع الأسيلة (Deacylation). تدخل جزيء الماء مهم.
انظر شكل تشكيل وفك معقد أسيل-إنزيم عند الكيموتريبسين فوق موقع تكوين