حركية الإنزيمات وفق ميكايليس-منتن الثوابت Km و Vmax والتعبيرات المختلفة للنشاط الأنزيمي
Enzymes. Michaelis-Menten kinetics, Km and Vmax parameters and different expressions of enzymatic activity
ENZYMOLOGY. VOCABULARY
| Arabic
|
English
|
French
|
| حركية الإنزيمات | Enzyme kinetic | Cinétique des enzymes |
| ركيزة | Substrate | Substrat |
| تشبع ميكايلي | Michaelian saturation | Saturation michaelienne |
| تشبع سيني | Sigmoid saturation | Saturation sigmïde |
التفاعلات الجزيئية للإنزيم (E) والركيزة (S)
Enzyme-Substrate molecular interactions
كيف تبدأ عملية التحفيز الإنزيمي ؟
تبدأ عملية التحفيز الإنزيمي بارتباط الركيزة (S) بالإنزيم (E) ليتشكل مؤقتا مركب إنزيمي أو معقد إنزيم-الركيزة (Complexe enzyme-substrat, ES). ثم يتحلل المعقد ES إلى نواتج (P) مع تحرر الإنزيم (E)، كما يبينه الرسم التالي.
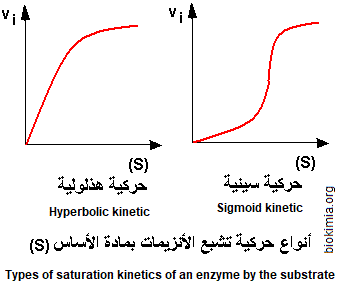
بينت دراسة سرعة ظهور النواتج (v) كدالة لتركيز الركيزة نوعين من تشبع الإنزيم بالركيزة حيث يمكننا التمييز بين "التشبع الهذلولي" (hyperbolic saturation) (أو تشبع ميكايلي، ميكايليس، 1902) و "التشبع السيني" (أو تفارغي)
أظهرت الدراسات أن المعقد ES يتحول إلى معقد آخر للإنزيم مع النواتج (معقد EP) قبل أن تفرز النواتج نفسها. للتبسيط، لن نعتبر المعقد EP في الشروحات الأولية، لكونه ما يلبث أن يتكون حتى يتحول بسرعة عالية إلى نواتج. في الظروف الفيزيولوجية، يوجد العديد من التفاعلات الإنزيمية في حالة انعكاسية (إمكانية الحصول على مواد الأساس و النواتج عند الاتزان). إلا أن هناك تفاعلات إنزيمية أخرى تكون غير انعكاسية الطبع، أي يغدو صعبا الحصول على الركيزة في التفاعل. تعرف السرعة الأولية (Vitesse initiale, initial velocity) للإنزيم ببداية ظهور النواتج (P) التي تتميز في هذه الظرفبة، بتركيزات ضئيلة جدا، لأن التفاعل يسير في اتجاه واحد (غير انعكاسي) كما يبينه الرسم التالي. هكذا يمكن استخراج معادلة سرعة التفاعل (Equation de vitesse de la réaction) مع احتساب الثوابت الحركية (Paramètres cinétiques) للإنزيم و التي تتمثل في ثابث ميكايلس (Constante de Michaelis, Km) والسرعة القصوى (Vitesse maximale, Vmax) للإنزيم.

الإنزيمات. الحركية الأنزيمية ومعادلة مايكليس-مينتين
Enzymes. Enzymatic kinetics and the Michaelis-Menten equation considering parameters Km and Vmax
يشتمل التفاعل المحفز بالإنزيم على ثلاثة تفاعلات بسيطة على الأقل يمكن تمثيلها بتسلسل التفاعل التالي:
, الإنزيمات
تثبيت الركيزة (S) على الإنزيم (E)، وتكوين المركب (ES)، تحويل الركيزة الثابتة (ES) إلى منتج (EP)، التفكك للمعقد (EP) وإطلاق المنتج (P).
التفكك للمعقد (EP) وإطلاق المنتج (P).
يصعب قياس معدل التفاعل في وجود S وP، خاصة في حالة التوازن!
نفضل قياس 'السرعة الأولية':
من المحبذ استخراج ثوابت التفاعل الإنزيمي ومعادلة سرعة التفاعل أثناء مرحلة السرعة الأولية التي تتميز بتركيزات ضئيلة جدا بالنسبة للنواتج.
ترتبط السرعة الأولية (vi)
للتفاعل بكمية الإنزيم في شكله المعقد مع الركيزة (ES) و الذي يلقب بالمعقد المنتج (Complexe productif). كلما ارتفع تركيز المعقد المنتج ارتفع معه نشاط الإنزيم و فرز النواتج:
vi = d[P]/dt = k2·(ES)
تركيز ES مرتبط جدا بقوة انجذاب S للإنزيم E. في 1912، انتبه ميكايليس (Michaelis) و مانتن
(Menten) لهذا الأمر بغية التكهن بكمية النواتج انطلاقا من تركيزات مواد الأساس.
- ثابت ميكايليس (Km).
سرعة تكون (Vitesse de formation) ES هي: vf = k1·(E)·(S)
سرعة تفكك(Vitesse de dissociation) ES هي: vd =
(k-1+ k2)·(ES)
عندما يصبح تركيز ES ثابتا، أي تعادل سرعات
التكون و التفكك، يمكن كتابة المعادلة:
vf = vd، أي: k1·(E)·(S)
= (k-1+ k2)·(ES)
نستخرج تركيز ES: (ES) = (E)·(S).k1/ (k-1+
k2)
لنضع: Km = (k-1+ k2) /k1
(ثابث ميكايليس، constante de Michaelis)، فنحصل على:
ES) = (E)·(S) / Km) أو:
Km = [(E).(S)]/(ES)
يمكن أن نستخلص من هذه المعادلة أن ارتفاع
تركيز المعقد المنتج (إرتفاع نشاط الإنزيم)
يقابله انخفاظ في ثابت ميكايليس (Km)،
أي أن قوة انجذاب الركيزة للإنزيم تقاس
بمقدار 1/Km. الذي يعني ألفة الإنزيم
للالركيزة (Affinité de l'enzyme pour le substrat).
ملاحظة: يتشابه ثابت ميكايليس (Km)
مع ثابت تفكك المعقد ES (Ks) و الذي تقاس
فيه ألفة E ل S ب 1/Ks، كذلك. إلا أن
Ks تساوي k-1/k1، عوض
(k-1 + k2)/k1، في حالة Km.
هكذا يعتبر Km مقياسا تقريبيا لثابت
تفكك المعقد ES، أي Ks.
- السرعة القصوى (Vmax).
سبق و أن بينا أن نشاط الإنزيم متعلق بكمية
الإنزيم في شكله المرتبط (ES)، أي: vi
= k2.(ES). السرعة القصوى هي سرعة التفاعل
عندما يصبح الأزيم كله (Enzyme totale, ET)
يساهم في التفاعل (كله مرتبط بالإنزيم).
في هذا الوضع، نكتب:
Vmax = k2.(ET)، مع: (ET)
= (E) + (ES)
هكذا، يكون مفهوم السرعة القصوى هو أقصى
ما يصل إليه الإنزيم من إعطاء للنواتج،
في زمن معين، في ظروف مثلى (Conditions optimales)
للتحفيز تشمل حرارة و pH مناسبين و خاصة
تركيز مرتفع للالركيزة (S).
إستخراج معادلة سرعة التفاعل الإنزيمي
نعرف أن: vi = k2.(ES). و Vmax
= k2.(ET) مع: (ET) = (E) + (ES)
نعرف مسبقا أن Km = [(E).(S)]/(ES) (= معادلة
1)
لنحسب العلاقة vi/Vmax:
vi/Vmax = k2.(ES)/k2.(ET)
vi/Vmax = (ES)/(ET) = (ES)/[(E)+(ES)] (معادلة 2)
لنستبدل (E) في المعادلة 2 بما يعادلها في المعادلة 1:
vi/Vmax = (ES)/[(ES).Km/(S)
+ (ES)] = 1/[1 + Km/(S)],
vi = Vmax.1/[1 + Km/(S)]
vi = Vmax. (S)/[(S) + Km] التي
يمكن أن تكتب كذلك:
تسمى هذه المعادلة معادلة ميكايليس-مانتان (Michaelis-Menten).
وهي تظهر أن السرعة الأولية (vi) للتحفيز الإنزيمي تمثل جزءا فقط من السرعة القصوى
(Vmax) و قد تتساوى vi و Vmax
عند تركيز جد مرتفع لالركيزة (S)،
أي تحول Km/(S) إلى صفر.
تمثيلية رسمية للتشبع الميكايلي
Graphical representation of Michaelian saturation

حالات خاصة للغاية:
1) (S)>> Km أي vi = Vmax·(S)/(S), vi = Vmax; السرعة الأولية مستقلة عن تركيز الركيزة, تشبع, الخط المقارب (asymptote) 1
2. (S)<< Km أي vi = Vmax·(S)/Km, الاعتماد الخطي لـ (S) (linear dependence to (S)), الحد من الركيزة، الخط المقارب 2 (limiting substrate, asymptote 2).
3. (S)= Km: أي vi = Vmax· Km / 2 Km, vi = Vmax / 2, نصف تشبع الانزيم (half saturation of the enzyme).
Vmax هي السرعة القصوى التي يمكن أن يصل إليها التفاعل عند تشبع الإنزيم بالركيزة
أي عندما (ET) = (ES).
Km هو تركيز الركيزة الذي يشبع الإنزيم إلى النصف.
وهو مقياس ألفة الإنزيم للركيزة: كلما زاد الألفة، قل Km.
يُطلق على k2 (= Vmax/(ET)) غالبًا ثابت التحفيز (catalytic constant) kcat.
غالبًا ما يتم تحديد نسبة kcat/Km كقياس ل كفاءة المحفز (catalytic efficiency) ,لأنه يتوافق مع معدل ثابت لتركيزات الركيزة المنخفضة (S) << Km، وبالتالي (E) = (ET)
vi= Vmax· (S)/ Km = kcat·(E)·(S)/ Km = (E)· (S)· kcat/Km
Linearization of the Michaelis-Menten equation
من الصعب رسم القطع الزائد (هدلول) يدويًا، إذ تحدث أخطاء في تقدير Vmax.لتبسيط التمثيل البياني لمعادلة ميكايليس-مينتن، قمنا بتحويل القطع الزائد إلى خطوط مستقيمة بمعادلات مختلفة (تغيير المحاور). المثال هو التحويل إلى منحنى Lineweaver-Burke:
1 / vi = 1 / Vmax + (Km / Vmax )· 1 /(S). تمثل هذه المعادلة خطًا مستقيمًا ذو ميل Km/Vmax
ويكون التقاطع على المحور الرأسي 1 /Vmax وعلى المحور الأفقي -1 / Km. إلى جانب هذا التمثيل، هناك العديد من التمثيلات الأخرى، بما في ذلك تمثيل Eadie-Hofstee وبواسطة هانز وولف (الشكل أدناه).

التثبيط بفائض الركيزة
Inhibition by excess of substrate
في العديد من الإنزيمات، يمكن للركيزة أن تشكل مجمعات من النوع ESS، والتي تكون غير تفاعلية بسبب وضع الركيزة بشكل غير صحيح في الموقع النشط. التثبيط بواسطة الركيزة الفائضة يشبه ذلك الذي يمارسه المثبط غير التنافسي (I) (مثبط غير تنافسي)، عن طريق استبدال I بالركيزة (S) . مجمع ESS ليس منتجًا (الشكل أدناه). سوف ينخفض KS وVmax بعامل (1 + (S)/KI). سيتم تقسيمهم جميعًا بنفس الطريقة العامل وستصبح معادلة السرعة كما يلي:

Share this information on social media تبادل المعلومة عبر المواقع الإجتماعية
 |
 |
 |
 |
Velocity equation and graphics of the enzyme inhibition by exces of substrate

Differents types of expressions of enzymatic activity
هناك عدة طرق للتعبير عن نشاط الإنزيم. بإمكاننا أن نذكر:
katal (kat), الوحدة الرسمية (الممارسة الطبية)، كمية الإنزيم التي تحفز تحويل 1 مول من الركيزة في الثانية. الكاتال لم يتم استخدامه أبدًا، لأنه كبير جدًا. يجب علينا استخدام وحدات فرعية مثل µkat (10-6 كاتال)، nkat (10-9 كاتال)، الوحدة المعتادة أو pkat (10-12 كاتال).
الوحدة الدولية (IU, International Unit)
IU المستخدمة من قبل معظم علماء الكيمياء الحيوية. وهو تعبير يتوافق مع كمية الإنزيم الذي يحفز تحويل 1 ميكرو;مول من الركيزة في الدقيقة في ظل الظروف المثالية. وبالتالي فإن 60 وحدة دولية تساوي 1 ميكروكات.
النشاط الجزيئي المحدد - (Molecular specific activity, MSA) : عددمولات الركيزة المحولة بواسطة مول من الإنزيم في الثانية. MSA هو سمة من سمات الانزيم. ولا يمكن حسابه إلا إذا كان التحضير الأنزيمية نقية. يتوافق MSA مع الثابت التحفيزي (kcat)، وعدد الدورات أو قلب التفاعل ويتم التعبير عنه بالثانية-1.
....تمرين حول التعبير
عن النشاط الإنزيمي.
عدد الدورات (kcat) هو عدد جزيئات الركيزة المحولة ب جزيء واحد من الإنزيم في الثانية (أو عدد مولات الركيزة المتحولة لكل مول من الإنزيم.
النشاط المولي - Molar activity هو عدد مولات الركيزة المتحولة لكل مول من الإنزيم في الدقيقة (كيلو كات × 60).
النشاط النوعي- Specific activity بدون معرفة الوزن الجزيئي للإنزيم، يمكن احتساب النشاط النوعي للإنزيم (SA)، أي النشاط لكل ملغ من البروتين النقي. عادة، يتم إعطاؤه بوحدة دولية (IU)/ملجم من البروتين
(أو µkat/mg).
إذا قمنا بحساب النشاط النوعي في مستخلص غير منقى (أي خليط البروتينات) فإن النشاط النوعي يدل على درجة نقاوة الإنزيم.
أثناء تنقية الإنزيم، نقوم بانتظام بقياس:
النشاط الإجمالي (IU أو µkat)، الكمية الإجمالية من البروتين (ملغ) والحجم الكلي للمحلول (مل). ومن هذه القيم الثلاث يمكننا حساب: SA والأداء (إجمالي النشاط / إجمالي النشاط قبل خطوة التطهير الأولى) ومعدل التنقية (نشاط محدد / نشاط محدد قبل خطوة التطهير الأولى). يصل النشاط المحدد ومعدل التنقية الحد الأقصى للقيمة عندما يكون الإنزيم نقيًا.
Can weblock an enzymatic reaction in vivo or in vitro? How?
نعم، يمكن القيام بذلك عن طريق عدة إجراءات بما في ذلك الاستخدام من المثبطات التي قد تكون أو لا تكون نظائرها الهيكلية للركائز الحقيقية من الانزيم. حسب أنواع المجمعات التي تتشكل في وجودها الإنزيم و/أو الركيزة وتعديل حركيتها التي تسببها، توصف المثبطات بأنها "تنافسية"، "غير تنافسية" أو "لا تنافسية" أو "مزيجة".
أمثلة من تطبيق المثبطات.
1/ السلفوناميدات (مضادات حيوية): نظائر بنيوية للحمض p-aminobenzoic acid، الركيزة للإنزيمات البكتيرية لخلق حمض الفوليك، الضروري لنمو البكتيريا.
2/ أدوية علاج الإيدز.
سؤال 1 - Q1 اختر المعلومة الخاطئة المتعلقة ب
Km (ثابت ميكاليس) للتفاعل المحفز بالإنزيم:
Select the INCORRECT information related to The Km (Michaelis constant) of an enzyme-catalyzed reaction:
(!هو مقياس لألفة الإنزيم للركيزة.
is a measure of the affinity of the enzyme for its substrate.)( تكون له قيمة عددية أعلى عندما يكون للإنزيم ألفة عالية تجاه الركيزة
has a higher numerical value when the enzyme has high affinity for its substrate)(!تكون له قيمة عددية أقل عندما يكون للإنزيم ألفة مرتفعة تجاه الركيزة.
has a lower numerical value when the enzyme has high affinity for its substrate.)(!هو تركيز الركيزة عندما تكون سرعة النشاط الإنزيمي نصف السرعة القصوى.
is the substrate concentration when the reaction rate is half of the maximum rate.)
سؤال 2 - Q2 بالنسبة للإنزيم، تنطبق جميع الافتراضات التالية على التحليلات الحركية لميكايليس-مينتن، باستثناء :
For an enzyme, All the following assumptions apply to Michaelis-Menten kinetic analyses, EXCEPT :
(يزيد Km عندما تزداد ألفة الإنزيم إلى الركيزة
Km increases when the affinity to the substrate increase)(!يتم الوصول إلى السرعة القصوى عندما يكون معقد الإنزيم والركيزة مساوياً للتركيز الكلي للإنزيم الموجود.
maximal velocity is reached when the enzyme-substrate complex is equal to the total concentration of enzyme present.)(!يجب قياس سرعة التفاعل الأولية لأن معظم الركيزة لم يتم تحويلها بعد إلى نواتج.
the initial reaction velocity should be measured because most of the substrate has not been converted to product.)
سؤال 3 - Q3
فيما يتعلق بالتعبير عن نشاط الإنزيم، فإن الكاتال هو:
Regarding the expression of enzyme activity, a katal is:
(!وحدة تصف كمية الركيزة بالمول المحولة إلى ناتج في دقيقة واحدة
a unit that describes the amount of substrate in moles converted to product in 1 minute )( تصف كمية الإنزيم الذي يحفز مولًا من الركيزة في ثانية واحدة
a unit that describes the amount of enzyme catalyzing a mole of substrate in 1 second)
VIDEO الإنزيمات، محفزات بيولوجية - Enzymes catalyseurs biologiques.
روابط مفيدة- USEFUL LINKS
- الإنزيمات. البنيات الوظيفية والموقع النشيط
Enzymes. Functional structures and active site
- الإنزيمات. تنقية وتطبيقات
Enzymes. Purification and applications
- الإنزيمات. ميكانزمات التحفيز
Enzymes. Catalysis mechanisms
بيتا جلاكتوسيداز. الثوابت الحركية وتأثير المثبطات
beta-galactosidase. Kinetic parameters (Km, Vmax) and the effect of inhibitors
- إنزيمات، إنزيمولوجيا
Enzymes, Enzymology
Livre 'Sciences de la vie. Protéines et Enzymes' (+ DVD), Baaziz, 2013: QCM corrigés, Exercices corrigés, Contrôles corrigés en Biologie cellulaire et Biochimie pour S1, S3, S4 et S5. Baaziz 2013
306 pages, 2013, ISBN : 978-99-54-32-663-3 + DVD mis à jour 2018 + Assistance
Afin d'encourager les illustrations vidéos des cours et données en biochimie, faite acquisition des livres de la préparation de la transition Secondaire-Supérieur et trouver toutes les vidéos sur les DVD accompagnant les ouvrages.

