

دراســــة أنزيــم بيتا جلاكتوسيداز (β-galactosidase)
beta-galactosidase, β-Galactosidase (EC 3.2.1.23, lactase, beta-gal or β-gal) is a glycoside hydrolase enzyme which catalyzes hydrolysis of terminal non-reducing β-D-galactose residues in β-D-galactosides.
تعتبر بيتا جلاكتوسيداز (β-galactosidase, β-gal, beta-galactosidase) إنزيما لحلمأة بيتا جلاكتوسيد (β-galactosides) مثل اللاكتوز أو سكر الحليب (Lactose)، إلى سكريات أحادية (Monosaccharides). عند بكتيريا Escherichia coli (E.coli) ، تمت دراسة حركية إنزيم β-gal باستعمال ستة تركيزات (معبر عنها ب M) من o-nitrophenyl-galactoside (ONPG) ، كركيزة اصطناعية (Synthetic substrate, S )، بحضور و غياب أحد المثبطات (inhibitors) الثلاثة من قبيل o-nitrophenyl-β-D-thiogalactoside (ONPTG) ، كمثبط اصطناعي (Synrhetic inhibitor) بتركيز 3.10-4 M ، سكر الشعير (المالتوز، Maltose) بتركيز 0.26 M و سكر الميليبيوز (Melibiose) بتركيز 0.17 M. بعد القيام بقياسات السرعة الأولية للإنزيم (إمتصاص الأشعة في الموجة بطول 410 نانومتر في الدقيقة، absorbance at 410 nm, A.min-1) في جميع الحالات و تحت ظروف 25°C و pH 7.7، أتت النتائج كالتالي:
| v مع الميليبيوز (0,17 M) | v مع المالتوز (0,26 M) | v مع ONPTG (3.10-4 M) | v بغياب المثبط | (S) M |
| 0,027 | 0,0165 | 0,018 | 0,033 | 2,5 10-5 |
| 0,041 | 0,0275 | 0,033 | 0,055 | 5,0 10-5 |
| 0,055 | 0,041 | 0,055 | 0,0825 | 1,0 10-4 |
| 0,069 | 0,059 | 0,091 | 0,118 | 2,5 10-4 |
| 0,075 | 0,069 | 0,118 | 0,138 | 5,0 10-4 |
| 0,079 | 0,075 | 0,138 | 0,150 | 1,0 10-3 |
من خلال رسم منحنيات Linweaver-Burk
(1/v = f(1/(S))، بغياب المثبطات (I) و بحضورها، حدد نوعية المثبطات الثلاثة لإنزيم بيتا جلاكتوسيداز عند بكتيريا E-coli مع احتساب الثوابت الحركية مثل السرعة القصوى بغياب المثبط(Vmax)
و بحضوره (Vmax') وثابت ميكايلس بغياب المثبط (Km) و بحضوره (Km').
ناقش وقع كل مثبط على نشاط إنزيم بيتا جلاكتوسيداز و العلاقة الترابطية بين الإنزيم
(E) و الركيزة (S) و المثبط (I).
2) احتسب ثابت أو ثوابت الإعاقة لكل مثبط (Ki و Ki') و قارن ألفة الإنزيم لكل مثبط.
1. حتى نتمكن من رسم منحنيات Linweaver-Burk (1/v = f(1/(S))، نبدأ باحتساب المقادير المقلوبة (Inverses) لتركيزات الركيزة ONPG (معبر عنها ب S) والسرعة الأولية (v) في شكل 1/(S) و 1/v. بالامكان استعمال برامج الحاسوب المختصة في هذا الميدان. رسم منحنى معادلة لينفيفر-بورك، طريقة أخرى لتفادي صعوبة تقدير Km وVmax، انطلاقا من منحنى ميكايليس-مانتان (v = f((S))). تعرف معادلة لينويفر-بورك ب 'المقلوب الزوجي' (Double inverses) ، إذ أنها توضح العلاقة بين مقلوب السرعة (1/vi) ومقلوب التركيز (1/(S)) وفقا لمقلوب معادلة ميكايليس-مانتان:
في حالة اشتغال الأنزيم بحضور أحد المثبطات الأنزيمية الثلاثة، نرسم المنحنيات المناسبة لاستخراج مقادير Vmax’ و Km’ (أنظر الرسم التالي).
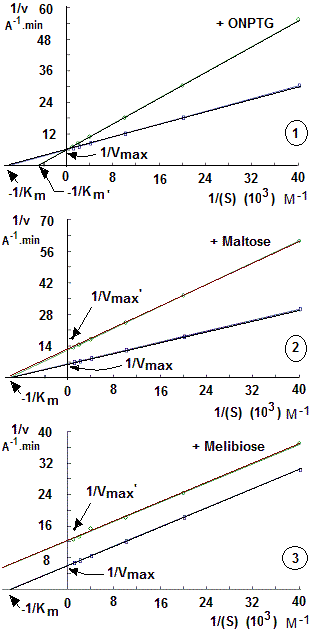
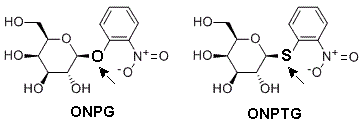
اعتمادا على الرسم (1)، نكتشف أن ONPTG يشتغل كمثبط عكسي تنافسي (Reversible competitive inhibitor) بالنسبة لالركيزة (ONPG)، إذ يقوم بخفض ألفة (Affinity) الأنزيم تجاه الركيزة (يقلل ارتباط الأنزيم ب ONPG) بدون أن يؤثر على السرعة القصوى (Vmax). كما هو معروف لذا المثبطات العكسية التنافسية، انخفاض ألفة الأنزيم مرتبط بارتفاع Km، حيث تصبح بحضور المثبط كالتالي:
Km' = Km.(1 + (I)/Ki).
، مع (I) يساوي تركيز المثبط و Ki يرمز إلى ثابت الإعاقة. يعود عدم تأثير المثبط على السرعة القصوى إلى عدم تكون معقدات ثلاثية (Ternary complexes) بين الأنزيم والركيزة والمثبط.
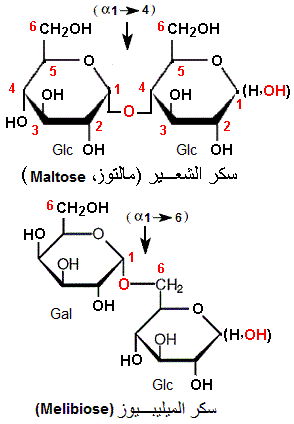
إنطلاقا من الرسم (2)، يظهر أن سكر الشعير (Maltose) يشتغل كمثبط غير تنافسي (Non-competitive inhibitor) بالنسبة لالركيزة (ONPG)، إذ لا يغير ألفة الأنزيم تجاه الركيزة، لكنه يقوم بخفض السرعة القصوى.
خفض Vmax يرجع إلى تكون معقد ثلاثي غير منتج (Non-productive Complex) بين الأنزيم والركيزة و المثبط.
الرسم (3)، يظهر أن سكر الميليبيوز (Melibiose) يشتغل كمثبط لا تنافسي (Uncompetitive inhibitor) بالنسبة للركيزة (ONPG)، إذ يقوم بخفض السرعة القصوى (تكون معقد ثلاثي غير منتج) مع حث الأنزيم على الارتباط ب ONPG، أي رفع الألفة (إنخفاض Km).
بالنسبة ل ONPG:
في كل الرسومات، نقطة تقاطع الخط المستقيم لالركيزة مع محور الأراتيب (Y axis) تساوي حوالي 6 A-1.min و هي تمثل 1/Vmax. إذن:
Vmax = 0,166 A.min-1
نقطة تقاطع الخط المستقيم ل ONPG وحده مع محور الأفاصيل (abscissa axis) في (1) تساوي حوالي:
-10. 103 M-1 ، أي أن ثابت ميكايلس يكون: Km = 1. 10-4 M.
بحضور (1) ONPTG: لا يحدث تغير في السرعة القصوى بوجود المثبط (Vmax’).
خفض Vmax يرجع إلى تكون معقد ثلاثي غير منتج (Non-productive complex) بين الأنزيم والركيزة و المثبط.
الرسم (3)، يظهر أن سكر الميليبيوز (Melibiose) يشتغل كمثبط لا تنافسي (uncompetitive inhibitor) بالنسبة لالركيزة (ONPG)، إذ يقوم بخفض السرعة القصوى (تكون معقد ثلاثي غير منتج) مع حث الأنزيم على الارتباط ب ONPG، أي رفع الألفة (إنخفاض Km).
بالنسبة ل ONPG:
في كل الرسومات، نقطة تقاطع الخط المستقيم مع محور الأراتيب (Y axis) تساوي حوالي 6 A-1.min و هي تمثل 1/Vmax. إذن: Vmax = 0,166 A.min-1
نقطة تقاطع الخط المستقيم ل ONPG وحده مع محور الأفاصيل (Abscissa axis) في (1) تساوي حوالي -10. 103 M-1 ، أي أن ثابت ميكايلس يكون: Km = 1. 10-4 M
بحضور ONPTG (1): لا يحدث تغير في السرعة القصوى بوجود المثبط (Vmax’). إذن: Vmax = Vmax’، بينما تصبح نقطة 1/Km’ تساوي حوالي -5. 103 M-1. إذن: Km’ = 2.10-4 M. هكذا يحدث ارتفاع في Km، أي انخفاض في ألفة الأنزيم لالركيزة، بحضور المثبط. نتبع نفس طرق الحسابات بالنسبة للمثبطات المتبقية الأخرى (رسوم 2 و3) لنحصل على Km’ يساوي 1.10-4 M و0.5.10-4 M بالنسبة للمالتوز والميليبيوز، بالتتالي.
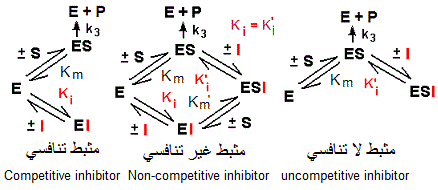
يبين الرسم التالي العلاقة الترابطية بين الأنزيم (E) والركيزة (S) والمثبط (I) في الحالات التثبيطية الثلاثة.
 |
 |
 |
 |
 |
كمثبط تنافسي، يرتبط ONPTG فقط بالأنزيم الحر(E) و لا يبدي أية ألفة للأنزيم المعقد مع مادة التفاعل (ES).
من الناحية البنيوية، يوجد تشابه كبير بين تركيب المثبط التنافسي (ONPTG) وتركيب الركيزة (ONPG)، كما يوضحه الرسم التالي، إذ يعتبر الأول مماثل بنيوي (Analogue structural) للثاني والعكس صحيح. بالتالي، تنتج المماثلات البنيوية تثبيطات عكسية تنافسية بالنسبة لمواد الأساس.
المالتوز (Maltose, 2 Glc)، مثبط غير تنافسي تجاه ONPG، يرتبط بنفس الألفة مع الأنزيم في شكليه E و ES، حيث لا يحدث أي تغير على Km بينما يخفض Vmax، لتصبح:
Vmax’ = Vmax/(1 + (I)/Ki)
الميليبيوز ( Melibiose, Gal + Glc) يختلف عن المالتوز بوجود ال جلاكتوز والرابطة الجليكوزيدية α1-> 6. عوض الرابطة α1- 4. لكونه مثبطا لا تنافسيا، لا يرتبط الميليبيوز إلا مع الأنزيم المرتبط مسبقا بالركيزة، أي ES. لهذا سميت المثبطات اللا تنافسية بالمثبطات المشروطة (Conditional inhibitors).
2. استخراج ثابت أو ثوابت الإعاقة لكل مثبط (Ki و Ki’) يتم بطرق مختلفة، من بينها رسم منحنيات ديكسون (1/v = f((I))) أو فقط احتساب الثوابت من نقط تقاطع الخطوط المستقيمة لكل مثبط فوق محاور الأراتيب و الأفاصيل في منحنيات لينويفر-بورك (1/v = f(1/(S))). مثلا، نقطة تقاطع الخط المستقيم ل ONPTG مع محور الأفاصيل (Axe des abscisses) تساوي حوالي -5.103 و هي تمثل -1/Km’، مع Km’ = Km.(1 + (I)/Ki). نعرف أن (I) = 3.10-4 M و Km = 1.10-4 M ، إذن
Ki = 3.10-4 M.
بالنسبة للمالتوز، نقطة تقاطع الخط المستقيم للمالتوز مع محور الأراتيب (Y axis) تساوي حوالي 12 A-1.min و هي تمثل 1/Vmax’. علما أن
Vmax’ = Vmax/(1 + (I)/Ki)
و أن (I) = 0,26 M و Vmax = 0,165 A.min-1، فإن Ki = 0,26 M.
بالنسبة للميليبييوز، نقطة تقاطع الخط المستقيم للميليبييوز مع محور الأراتيب (Y axis) تساوي حوالي 12 A-1.min و هي تمثل 1/Vmax’. علما أن
Vmax’ = Vmax/(1 + (I)/Ki’)
و أن (I) = 0,17 M و Vmax = 0,165 A.min-1، فإن Ki’ = 0,17 M.
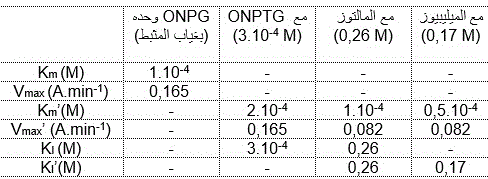
يعطي الجدول التالي مقارنة لجميع الثوابت الحركية الذي يمتاز بهم أنزيم بيتا جلاكتوسيداز ل E.coli بغياب و بحضور المثبطات مثل ONPTG و المالتوز والميليبيوز.
روابط مفيدة - useful links
- إنزيمات. لائحة enzymes-enzymology-index
- الإنزيمات. تنقية وتطبيقات - Enzymes. Purification and applications
- الإنزيمات. البنيات الوظيفية والموقع النشيط
- Enzymes. Functional structures and active site
- حركية الإنزيمات وفق ميكايليس-منت الثوابت Km و Vmax والتعبيرات المختلفة للنشاط الأنزيمين
Enzymes. Michaelis-Menten kinetics, Km and Vmax parameters and different expressions of enzymatic activity
- CATALYSE. INTERACTIONS MOLECULAIRES ENZYME SUBSTRAT- INHIBITEUR