
PHARMA3 ACCESS APPLI.

ACIDES AMINES EN TANT QUE CONSTITUANTS DES PROTEINES
Les acides aminés constituent les bases des protéines qui peuvent provenir de la traduction d'un ARN messager:

.... Pour détails, voir: Visualisation 3D des acides aminés: Acides aminés visualisation
Les acides aminés (acides alpha-aminés) sont formés de 3 composantes essentielles:
- La fonction acide (-COOH),
- la fonction amine (-NH2) et
- le radical R qui change d'un acide aminé à un autre et fait ainsi, la différence entres les différents acides aminés.
Exemple de la Sérine:
Les acides aminés sont des acides alpha-aminés, car la fonction amine est liée au carbone numéro 2.
AVERTISSEMENT: Le nombre d'acides aminés PROTEOGENES (formant des protéines) est 20. Cependant, le nombre d'acides aminés chez les plantes en particulier, est plus élevé!!:
Chez les végétaux, deux autres groupes d'acides aminés peuvent être rencontrés:
- A. aminés non incorporés dans les protéines mais pouvant jouer un rôle dans certains processus métaboliques.
C'est le cas de la citrulline et de l'ornithine qui interviennent dans le cycle de l'urée.
- A. aminés spécifiques de certaines espèces de plantes. Au nombre dépassant 240, ils peuvent être considérés
comme des métabolites secondaires.
ATTENTION: Sans être rattachée aux plantes, la béta-alanine, rentrant dans la structure de plusieurs molécules, comme la carnosine (dipeptide résultant de la digestion des viandes, dans muscle et cerveau), est un acide aminé NON PROTEINOGENE.
(détail: carnosine)
À l'exception de la glycine, les acides alpha-aminés se caractérisent par la fixation de leur carbone alpha à des groupes chimiques différentes.
C'est un carbone asymétrique ou carbone chiral qui agit comme un centre optiquement actif qui dévie la lumière vers la droite (dextrogyre, D) ou vers la gauche (lévogyre, L).
De ce fait, les acides alpha-aminés existent sous forme de deux isomères structurellement identiques mais possédant des propriétés différentes. C'est une stéréoisomérie. Ainsi, chaque acide aminé D est analogue à un acide aminé L. Le schéma suivant illustre l'isomérie de la D-alanine et de la L-alanine.

La synthèse chimique des molécules chirales produit un mélange neutre d'énantiomères appelé mélange racémique (mélange en proportions égales des énantiomères L et D d'un composé chiral). En revanche, les réactions biochimiques restent stéréospécifiques.
La plupart des acides alpha-aminés composent les protéines existant sous forme L, et non D, contrairement à la plupart des sucres naturels, qui existent sous forme D.
La proline = acide iminé. Elle a une amine secondaire. Les autres acides aminés ont une amine primaire sur le carbone alpha (C2).
Les acides aminés aromatiques, tels que le tryptophane, la tyrosine et la phénylalanine, absorbent la lumière ultraviolette (UV) dans la région de 260 à 280 nm. Ils n'absorbent pas la lumière dans la région visible du spectre.
ACIDES AMINES POLAIRES ET ACIDES AMINES APOLAIRES
Les acides aminés (AA) peuvent être subdivisés en:
- Acides aminés polaires (أحماض أمينية قطبية) (11 AA).
- Acides aminés apolaires (9 AA) (أحماض أمينية غير قطبية) ).
ACIDES AMINES POLAIRES - أحماض أمينية قطبية
Les AA polaires sont au nombre de 11:
Les AA polaires peuvent être subdivisés en:
- Acides aminés polaires non chargés ou neutres (6 AA à R non ionisable: Ser et Thr (AA alcool), Asn et Gln (AA amides), Cys, Tyr). Ils sont retenus par la phrase mnémonique 'Glenn Tire et Cisaille, THéo CERrtifie: c'est un ASsassin'.
- Acides amines polaires chargés (-) (2 AA appelés aussi AA acides: Asp et Glu)
- Acides amines polaires chargés (+) (3 AA appelés aussi AA basiques: Lys, Arg et His).
ACIDES AMINES APOLAIRES - أحماض أمينية لا قطبية
Les AA apolaires sont au nombre de 9:
Les acides aminés apolaires, (hydrophobes), sont des AA dont les chaînes latérales sont non polaires, ne contenant pas de groupes polaires comme OH (alcool), SH (thiol) ou NH (amine), ce qui signifie qu'elles n'interagissent pas facilement avec l'eau. Ils ont tendance à se regrouper au centre des protéines, à l'abri de l'eau, et à être impliqués dans l'adhérence de la protéine à des surfaces non polaires et des interactions non covalentes, comme les interactions hydrophobes, avec d'autres molécules non polaires.
Exemples d'acides aminés apolaires: Ala, Val, Leu, Ile, Met (-SH non polaire), Phe, Trp et Pro (R sous forme d'un cycle qui la rend rigide et hydrophobe).
Remarque: 6 AA essentiels (Val, Leu, Ile, Met, Phe et Trp) font partie de la série des AA apolaires, exceptées la Proline, l'Alanine et la Glycine (voir liste des AA apolaires).
EXEMPLE DE CLASSIFICATION DES ACIDES AMINES
En plus d'être classés en Acides aminés polaires et Acide aminés apolaires, les acides aminés peuvent être classés en:
1/ Acides aminés à chaîne hydrocarbonnée (الأحماض الأمينية ذات سلسلة هيدروكاربونية ) comprenant les acides aminés Gly, Ala et 3 A. aminés essentiels, dont La Val, Leu, Ile (A. aminés ramifiés). Ces A. aminés sont dit indispensables (essentiels). Seul un apport alimentaire peut les mettre à la disposition de notre organisme.
Lien: Acides amines R-hydrocarbonnée.
...
...
...
...
2/ Acides aminés hydroxylés comprenant la Thr et Ser. Ce sont des AA alcools.
Lien: Acides amines hydroxylés...
3/ Acides aminés soufrés contenant Met et Cys
Lien: Acides amines soufrés
...
4/ Acides aminés dicarboxyliques contenant Asp et Glu
Source: Acides amines dicarboxyliques
...
5/ Acides aminés basiques comprenant Lys, Arg et His
Source: Acides aminesbasiques
...
...
6/ Acides aminés à fonction amide comprenant Asn et Gln
Source: Acides amines amides
...
7/ Acides aminés cycliques comprenant Phe, Tyr, Trp et Pro
Source: Acides aminescycliques
...
...
...
REMARQUE: On parle parfois d'acides aminés aromatiques où l'histidine y appartient. Ils sont: Phe, Tyr, Trp, His .
ACIDES AMINES ESSENTIELS ET ACIDES AMINES NON ESSENTIELS
La plupart des chimiotrophes, et les mammifères en particulier, ne peuvent synthétiser que 11 des 20 a. aminés: ces a. aminés sont dits ACIDES AMINES NON ESSENTIELS. L'Arginine (semi-essentielle, est comtabilisée ici comme AA non essentiel.
Il existe 11 acides aminés non essentiels, contrairement aux 9 acides aminés essentiels qui doivent être apportés par l'alimentation.
Liste des 11 acides aminés non essentiels :
Glycine, Alanine, Acide aspartique, Acide glutamique, Asparagine,Glutamine, Cystéine, Sérine, Tyrosine, Proline, Arginine.
- La sérine dérive de la thréonine (AA essentiel). Ce sont 2 AA alcool.
- La Cystéine dérive de la Méthionne (AA essentiel). Ce sont 2 AA soufrés.
- La Tyrosine dérive de la Phénylalanine (AA essentiel). Ce sont 2 AA aromatiques.
- La proline dérive de
Avertissement: Pour l'Arginine, classée ici AA non essentiel, est un AA considéré aussi 'SEMI-ESSENTIEL', ce qui signifie que l'organisme peut le produire, mais pas toujours en quantité suffisante pour répondre aux besoins. Un apport extérieur est souvent nécessaire. On la trouve dans de nombreux aliments riches en protéines, comme la viande, le poisson, les produits laitiers et les légumineuses.
Pour les 9 autres a. aminés, soit les organismes ne possèdent pas les enzymes qui les catalysent, soit ceux-ci sont synthétisés en quantité trop minime pour le bon fonctionnement de l'organisme.
Ces 9 ac. aminés sont dits ACIDES AMINES ESSENTIELS et doivent être apportés par l'alimentation. Il s'agit de:
- Acides aminés à chaînes ramifiées (Val, Ile, Leu) (l'Homme ne sait pas faire les ramifications !)
- Acides aminés comportant un noyau aromatique (ici: Phe, Trp).
- Acides aminés: His, Thr, Met et Lys.
Arg n'est pas incluse car considérée comme semi-essentielle.
Il existe une expression française qui aide à se souvenir des acides aminés essentiels: « Mets Le dans la VaLise, Il Fait Trop d’HisToire ». Elle fait référence, du début à la fin de la phrase, aux symboles des acides aminés, comme suit : Met, Leu, Val, Lys, Ile, Phe, Trp, His, Thr.
Les a. aminés essentiels font appel à des alpha-cétoacides (squelettes carbonés) dont seules les plantes sont capables de
faire la biosynthèse. Le chloroplaste possède des enzymes nécessaires à leur formation.
Les plantes et certains microorganismes sont capables de synthétiser les 20 a. aminés en utilisant, les oxydes d'azote ou l'ammoniac comme source d'azote (détail sur la biosynthèse des acides aminés ).
LES ACIDES AMINES SONT DES MOLECULES IONISABLES
L'ionisation (تأين) des acides aminés à des pH précis donne naissance à plusieurs formes moléculaires chrargées positivement (+) ou négativement (-) ou de charge électrique globale nulle (+/-).
Les courbes de titration reflètent la composition de la solution de l'acides aminé en telle ou telle forme moléculaire.
La fonction COOH de l'acide aminé portée par le carbone alpha est ionisable.
Pour le cas de la glycine:
- A un pH proche de 2.3 (pK1), l'acide aminé est sous formes A+ (50%) et A+- (50%)
- A un pH proche de 9.6 (pK2), l'acide aminé est sous formes A+- (50%) et A- (50%)
- A un pH proche de 6.0 (pHi), l'acide aminé est sous la forme A+- (100%)
Le radical R des acides aminé peut être ionisable ou non.
Les acides aminés à radical non ionisable sont ceux dont la chaîne latérale (R) ne porte pas de groupes fonctionnels qui peuvent se charger ou se décharger en fonction du pH. En d'autres termes, ces groupes R ne peuvent pas subir de réactions d'ionisation à pH physiologiques.
Exemples d'acides aminés à radical non ionisable :
- Acides aminés aliphatiques: Glycine (Gly), Alanine (Ala), Valine (Val), Leucine (Leu), Isoleucine (Ile), Méthionine (Met).
- Acides aminés aromatiques: Phénylalanine (Phe), Tryptophane (Trp).
- Proline (Pro): Un acide aminé cyclique qui n'est pas non plus ionisable.
- Acides aminés polaires non ionisables : Sérine (Ser), Thréonine (Thr), Cystéine (Cys), Tyrosine (Tyr), Asparagine (Asn), Glutamine (Gln).
- Acides aminés non polaires: Valine (Val), Leucine (Leu), Isoleucine (Ile).
Importance des radicaux non ionisables : Les radicaux non ionisables contribuent à la structure tridimensionnelle des protéines et à leurs interactions avec d'autres molécules, notamment via des liaisons hydrogène.
D'autre part, l'attraction d'un substrat vers le site actif d'une enzyme est souvent guidée par des interactions hydrophobes entre des motifs structuraux du sbstrat et les radicaux libres de quelques acides aminés du site actif.
QUESTION 1.
Le carbone 1 des acides aminés s'appelle carbone alpha (Faux)(!Vrai)
QUESTION 2.
Choisir la ou les information(s) correcte(s) concernant les Acides aminés (Le nombre d'acides aminés protéinogènes est 20)(le radical R des Ac. aminés change d'un acide aminé à un autre)(!La béta-alanine est un acide aminé protéinogène)(!Certains Ac. aminés peuvent posséder plus de deux fonctions acides)
QUESTION 3.
Choisir l'information correcte concernant les Acides aminés (choisir une seule réponse) (N'interagissant pas facilement avec l'eau. les ac. aminés apolaires ont tendance à se regrouper au centre des protéines, à l'abri de l'eau)(!La proline entraine une grande flexibilité structurale des protéines dans lesquelles elle se trouve)(!Tous les Ac. aminés naturels sont de la série D.)
QUESTION 4.
Quelle est la séquence des acides aminés 1-2-3-4 ? de la figure suivante:
(Cys-Thr-His-Ser )(!Trp-Asn-Leu-Met )
QUESTION 5.
Quelle est l'acide aminé montré dans la figure suivante:
(Arginine)(!Sérine)(!Phénylalanine)
QUESTION 6.
Choisir l'information correcte concernant les 20 Ac. aminés (cocher une seule réponse) (!Le tryptophane - Trp - présente une absorption minimale à 280 nm)(!Le tryptophane - Trp - présente une absorption maximale à 260 nm)(!Les Ac. aminés Trp, Phe, His et Tyr absorbent tous la lumière dans le proche ultraviolet - 250-300 nm -)(Les Ac. aminés n'absorbent pas la lumière dans le visible)
QUESTION 7.
Choisir la ou les informatio(s) correcte(s) concernant la thréonine (Possède un groupement hydroxyle)(Possède deux carbones asymétriques C2 et C3)(!Est un acide aminé non essentiel)
QUESTION 8.
C'est un acide aminé sans carbone asymétrique. Son groupement carboxylique est plus acide (pK1 = 2.3). Il a un goût sucré. De quel acide aminé s'agit-il ? (Glycine)(!Valine)(!Histidine)(!Sérine)
QUESTION 9.
A propos de la Thréonine (Thr) et de la Sérine (Ser): (Thr est précurseur de Ser)(Thr et Ser sont deux acides aminés alcools)(!Thr est un ac. aminé non essentiel)(!Ser est un ac. aminé essentiel)
QUESTION 10.
A propos de la Méthionine (Met) et de la Cystéine (Cys): (Met est précurseur de Cys)(Met et Cys sont deux acides aminés soufrés)(Met est un ac. aminé essentiel)(!Cys est un ac. aminé essentiel)(Cys est un ac. aminé polaire)(Met est un ac. aminé apolaire)
QUESTION 11.
A propos de la Phénylalanine (Phe) et de la Tyrosine (Tyr): (Phe est précurseur de Tyr)(Phe et Tyr sont deux acides aromatiques)(Phe est un ac. aminé essentiel)(!Tyr est un ac. aminé essentiel)(Tyr est un ac. aminé polaire)(Phe est un ac. aminé apolaire)
QUESTION 12.
C'est un acide aminé non essentiel car pouvant être fabriqué à partir de la phénylalanine (parahydoxyphénylalanine). De quel acide aminé s'agit-il ?:- cocher une seule réponse - (Tyrosine)(!Glycine)(!Sérine)(!Isoleucine)
QUESTION 13.
En se basant sur la classification des Ac. aminés selon la polarité, les Ac. aminés Glutamine (Gln), Tyrosine (Tyr), Cystéine (Cys), Thréonine (Thr), Serine (Ser) et Asparagine (Asn) retenus par la phrase mnémonique 'Glenn Tire et Cisaille, THéo CERrtifie: c'est un ASsassin') sont:? (!Ac. aminés polaires basiques)(Ac. aminés polaires neutres)(!Ac. aminés apolaires)
QUESTION 14.
Les acides aminés Lys, Arg et His sont: (Ac. aminés polaires basiques chargés +)(!Ac. aminés polaires neutres)(!Ac. aminés apolaires)
QUESTION 15.
Les acides aminés Sérine (Ser), Thréonine (Thr), Cystéine (Cys), Tyrosine (Tyr), Asparagine (Asn), Glutamine (Gln) sont: (!Ac. aminés polaires basiques)(Ac. aminés polaires non ionisables)(!Ac. aminés apolaires)(!Ac. aminés polaires ionisables)
QUESTION 16.
Le pHi d'un acide aminé est: (Le pH auquel sa charge électrique est nulle )(Le pH coïncidant avec 100% de sa forme A+-)(!Le pH coïncidant avec 50% de forme A+ et 50% de forme A+-)(!Le pH coïncidant avec son pK1)(!Le pH coïncidant avec son pK2)
QUESTION 17.
A un pH proche de 6.0 (pHi), la glycine est sous la ou les forme(s) (!formes A+- : 50% et A- : 50% )(A+- : 100%)(!formes A+: 50% et A+-: 50%)
Source: Peptides, Protéines ------ Peptides. Structure 3D 
Les
peptides (بيبتيدات) sont constitués d'un nombre déterminé d'acides aminés liés entre eux par des liaisons peptidiques. On parle de peptides pour les molécules de moins de 100 acides aminés.
Les oligopeptides contiennent un nombre réduit d'acides aminés (deux à une dizaine). Les polypeptides sont formé de 10 à 100 acides aminés. On parle souvent de protéines lorsque le nombre d'acides aminés dépasse 100.
Pour former des peptides ou des protéines, les acides aminés se lient les uns aux autres par des liaisons covalentes appelées LIAISONS PEPTIDIQUES ou liaisons amides (acide + alcool: CO-NH), connectant le carboxyle porté par le carbone alpha du premier acide aminé avec le groupement amine fixé sur le carbone alpha du deuxième acide aminé. C'est une liaoson AMIDE.
La liaison peptidique est stabilisée par mésomérie où les électrons de la liaison sont délocalisés, ce qui fait que la longueur de la liaison est intermédiaire entre une simple et une double liaison. Ainsi, la liaison peptidique est plus stable et plus résistance à la rotation.
- Les oligopeptides:
Les peptides constitués de deux à quelques dizaines d'acides aminés (2-10 AA) sont appelés 'oligopeptides'.
Les oligopeptides ne résultent pas de la traduction d'ARNm (ARN messager).
Ainsi, on trouve des dipeptides (2 acides aminés), tétrapeptides (4 acides aminés) et ainsi de suite.
L'écriture du nom d'un peptide commence par l'écriture, en ordre, des noms de tous les acides aminés qui le composent en ajoutant 'yl' après chaque nom et en commençant par l'acide aminé de l'extrêmité N-terminale libre, excepté le nom du dernier acide aminé.
Exemple: Leu-Gly-Cys appelé: Leucyl-glycyl-cystéine.
Dipeptide spécial. Aspartame (édulcorant)
Aspartame: peptide spécial de deux acides aminés (dipeptide): Asp et Phe estétifiée avec un méthyl (du méthanol) sur le groupe hydroxyle (OH) porté par le carbone 1 (celui du carboxyle COOH). Asp est un acide aminé polaire non essentiel. Phe est un acide aminé non polaire et essentiel.
L'aspartame est un édulcorant à goût sucré (pouvoir sucrant environ 200 fois supérieur à celui du saccharose) utilisé comme additif alimentaire. Son utilisation a été critiquée considérant l'effet qu'il pourrait présenter sur la santé humaine.
Localisez la liaison peptidique dans l'aspartame:
La consommation abusée de l'apartame cause la phénylcétonurie (PKU).
Exemple d'oligopeptide particulier. Le Glutathion (tripeptide).
Le glutathion est un exemple de tripeptide. Il est composé d'acide glutamique (Glu), de cystéine (Cys) et de glycine (Gly).
Le glutathion est un cas particulier d'oligopeptides, car Glu et Cys sont reliés par une liaison carboxyle, le carboxyle étant situé sur le carbone 4 (le carbone γ; le carbone de du COOH du radical) au lieu du carbone 2 (le carbone α), comme illustré dans la figure suivante.

Le glutathion est un antioxydant important dans la protection contre le cancer.
- Les polypeptides:
- Les polypeptides d'environ 30-100 acides aminés résultent de la traduction d'ARNm.
Le glucagon, hormone hyperglycémiante de 29 acides aminés (hormone peptidique), est un exemple de polypeptides.

L'insuline, hormone hypoglycémiante (le manque dans l'organisme donne le diabète), est un polypeptide constitué de 51 acides aminés, répartis sur deux chaînes, A et B avec 21 et 30 acides aminés, respectivement.

- Les protéines contiennent plus de 100 acides aminés:
Notion de pHi pour les protéines, peptides et acides aminés
Pour calculer le pHi d'un peptide donné (ici un octapeptide), il faut d'abord connaître sa composition en acides aminés.
- On commence à classer les groupements ionisables du peptide (Amine terminal, carboxyl terminal, radicaux R des différents acides aminés) par ordre décroissant de leur acidité (= ordre croissant des valeurs des pK) et
- On écrit les équilibres de dissociation en commençant par le pK le plus faible (groupements se dissociant le premier). On part de la forme du peptide la plus saturée (avec les protons H+).
La valeur du pHi du peptide est la moyenne des pK qui entourent la forme du peptide à charge électrique nulle (P 2+, 2-, ici).
Dans cet exemple, pHi = (pK2 + pK3)/2.

Application de la notion du pHi. Précipitation des protéines du lait par acidification (application de la notion de pHi)
Les protéines du lait sont constituées en majorité de caséine qui a un pHi acide de l'ordre de 4,6. Pour séparer les protéines du lactosérum (contenant le lactose), on utilise la précipitation au pHi.
Liaisons chimiques entre les acides aminés dans les protéines
Outre les liaisons peptidiques qui se forment entre les groupes amino et carboxyle des acides aminés lors de la formation d'une protéine dans sa structure primaire, d'autres liaisons peuvent se former entre les groupes R d'acides aminés situés plus loin les uns des autres dans la structure protéique. Cela donne naissance à différentes structures qui modifient la forme de la protéine dans d'autres dimensions, se manifestant par des structures secondaires, tertiaires et quaternaires.
Les liaisons chimiques qui jouent un rôle important dans la formation des structures protéiques peuvent être classées en cinq types (outre la liaison peptidique), comme illustré dans le schéma suivant. Elles sont les suivantes :

- Liaisons hydrogène : Ces liaisons relient des parties éloignées ou proches de la protéine, comme celles qui se forment entre (O) dans C=O et (H) dans NH, présentes dans des liaisons peptidiques adjacentes.
- Liaisons de Van der Waals :
Sont plus faibles que les liaisons hydrogène, elles apparaissent lorsqu'un pôle temporaire se forme à une extrémité apolaire, forçant ce pôle à former un pôle de charge opposée à une deuxième extrémité apolaire proche. Cela crée un dipôle de même force mais de charges opposées, séparées par une courte distance.
- Liaisons ioniques : Elles se forment entre un groupe carboxyle libre à une extrémité d'une protéine et un groupe amine libre à l'autre extrémité. Par exemple, la liaison entre -COO- du radical de l'acide glutamique et -NH3+ du radical de la lysine.
- Liaisons disulfures : Ces liaisons se forment en milieu oxydant entre deux atomes de soufre (sous la forme -SH) de deux acides aminés Cys, séparés par une certaine distance. Ce sont des liaisons covalentes, contrairement aux autres liaisons, qui sont non covalentes. C'est ainsi qu'un pont disulfure S-S se forme. Pour rappel, l'oxydation de deux molécules de cystéine produit de la cystine (Cys-Cys), que l'on peut classer comme un acide aminé bivalent ou un dipeptide. Les ponts disulfures jouent un rôle important dans le maintien de la structure de nombreuses protéines et peptides, tels que ceux contenus dans les venins de serpent et de scorpion.
- Liaisons apolaires ou hydrophobes : Elles se forment entre des molécules apolaires en solution aqueuse. Dans le cas des protéines, des liaisons hydrophobes se forment entre les chaînes latérales des acides aminés apolaires. Les groupes apolaires repoussent l'eau et s'attirent mutuellement, comme les groupes vinyle (-CH=CH2) ou méthyle sur les chaînes latérales des acides aminés. Les liaisons hydrophobes forcent la protéine à adopter une conformation favorable, cachant les acides aminés apolaires (hydrophobes) à l'intérieur et les acides aminés non hydrophobes (polaires) à l'extérieur.
Les interaction hydrophobes jouent un rôle très important dans le positionnement du substrat au sein du site actif d'une enzyme.
Par exemple, l'hémine de la peroxydase se trouve dans une poche limitée par des résidus ac.aminés surtout hydrophobes (zone apolaire), les seuls groupements polaires à proximité appartiennent à His 42, Arg 38 et His 170.

Le site actif présente une poche avec deux régions:
- Région hydrophobe.
- Région hydrophile.
Le substrat est logé dans une poche dans laquelle il oriente d'une part son cycle apolaire vers la partie hydrophobe constituée par les Ac. aminés Phe179, Pro141, Ala140, Pro139, Phe 68, Gly 69 (+ une portion de L'hème) et d'autre part ses parties polaires vers His 42 et Arg 38 , à proximité du fer.
Rôle des ponts disulfures dans la structure et la fonction des protéines
Lors de l'oxydation de deux molécules de cystéine (Cys), la cystine est produite, un acide aminé dipeptidique (cas unique) dépourvu de liaisons peptidiques (voir figure suivante).
Pour rappel, la cystine (produit d'oxydation) est un solide blanc qui constitue environ 5% du poids des cheveux humains et produit des cristaux de cystine dans le foie lorsque sa teneur dans l'organisme est élevée.
Lorsqu'un pont disulfure est réduit par le β-mercaptoéthanol (HS-CH2-CH2-OH) ou d'autres réducteurs, deux molécules de cystéine sont produites, ce qui peut affecter la structure et la fonction des protéines.
La réduction des ponts disulfures peut se produire au sein d'une même protéine ou entre différentes protéines en présence de mercaptoéthanol comme agent réducteur, comme illustré par les deux réactions ci-dessous:
Pour éviter l'oxydation des groupes SH dans la cystéine (formation de ponts –S-S-), qui conduit à des changements dans la structure et la fonction de la protéine (exemple d'une enzyme), le mercaptoéthanol est souvent utilisé dans l'extraction de protéines et d'enzymes, car c'est un agent réducteur qui protège contre l'oxydation des groupes SH dans les protéines et préserve leur structure fonctionnelle.
Dans les protéines, les ponts disulfures jouent un rôle important dans les structures tertiaires (repliement des protéines) et quaternaires (dépliement ou dépliement des sous-unités protéiques). Toute modification des ponts disulfures d'une protéine peut altérer profondément sa structure et sa fonction biologique.
Par exemple, la ricine, une toxine présente dans certaines plantes, perd toute son efficacité après la rupture du pont disulfure reliant la chaîne A à la chaîne B du peptide toxique.
Le même phénomène peut se produire avec les anticorps, formés par la liaison de quatre chaînes (deux lourdes et deux légères) via des ponts disulfures (voir figure). Les immunoglobulines sont des glycoprotéines formées de 4 chaînes polypeptidiques: 2 chaînes lourdes et 2 chaînes légères

QUESTION 18.
La liaison peptidique liant les acides aminés dans la structure primaire correspond à: (! Liaison conférant un pouvoir rotatoire aux protéines)(Liaison plane -liaison 'pi' rigide-)
QUESTION 19.
Les oligopeptides contiennent un nombre d'acides aminés: (compris entre 2 et 10)(!compris entre 10 et 100)(!supérieur à 100)
QUESTION 20.
Un peptides contiennent un nombre d'acides aminés: (inférieur à 100)(!supérieur à 100)
QUESTION 21.
La liaison peptidique est de type: (Amide)(!Ester)(!Acétal)
QUESTION 22.
Dans un peptide, l'acide aminé numéro 1 est situé: (à gauche, c'est à dire du côté N-terminal)(!à droite, c'est à diredu côté N-terminal)(!à droite, c'est à dire du côté C-terminal)(!à gauche, c'est à dire du côté C-terminal)
QUESTION 23.
Les oligopeptides ne résultent pas de la traduction d'ARNm (ARN messager) (Vrai)(!Faux)
QUESTION 24.
Le glucagon, hormone hyperglycémiante de 29 acides aminés (hormone peptidique), est un exemple de: (Polypeptides)(!Oligopeptides)(!Protéines)
QUESTION 25.
Dans la nomenclature d'un peptide, le nom de l'acide aminé C-terminal se termine par 'yl': (Faux)(!Vrai)
QUESTION 26.
A propos de l'aspartame: (C'est un édulcorant artificiel)(Contient du méthanol)(!Contient l'acide aspartique et la sérine)
QUESTION 27.
A propos du glutathion: (!C'est un tripeptide formé des acides aminé Glu, Cys et sérine)(C'et un tripeptide particulier où la liaison peptidique entre Glu et Cys engage la fonction COOH du radical du Glu et la fonction amine de Cys)(C'est un antioxydant)
QUESTION 28.
A propos des peptides: (Ne dépassent pas 100 acides aminés)(!Un oligopeptide est constitué de 2 à 20 acides aminés)(Un oligopeptide ne provient pas de la traduction d'un ARN messager)
QUESTION 29.
A propos des protéines (P): (A un pH égal à leur pHi, elles sont moins solubles et précipitent)(!A leur pHi, elles sont chargées P+)(!A un pH égal à leur pHi, elles sont plus solubles)(!A leur pHi, elles sont chargées P-)
QUESTION 30.
Les liaisons hydrogène se forment entre (O) dans C=O et (H) dans NH, présentes dans des liaisons peptidiques adjacentes: (Vrai)(!Faux)
QUESTION 31.
Les ponts disulfures: (se forment entre deux cystéines)(!se forment entre COOH d'un acide aminé dicarboxylique et NH2 d'un acide aminé basique)
QUESTION 32.
Les interactions hydrophobes joue un rôle important dans le positionnement du substrat dans le site actif d'une enzyme: (Vrai)(!Faux)
QUESTION 33.
La cystine: (C'est un acide aminé dipeptidique)(!présente une liaison peptidique)(se forme par un pont entre deux cystéines)
QUESTION 34.
β-mercaptoéthanol est un agent réducteur qui protège les protéines contre l'oxydation des groups thiols -SH: (Vrai)(!Faux)
QUESTION 35.
Concernant les anticorps: (sont à 4 chaines peptidiques liées avec des ponts disulfures interchaines)(!sont à 4 chaines peptidiques liées avec des liaisons hydrophobes)(!sont à 4 chaines peptidiques liées avec des liaisons hydrogène)(!sont à chaines peptidiques sans ponts disulfures intrachaine)

Les protéines sont des composés constitués de plusieurs éléments chimiques dont le carbone (C), l'hydrogène (H), l'oxygène (O), l'Azote (N) et pour certaines protéines, le soufre (S) et le phosphore (P). L'azote constitue 16% de tous les constituants.
Proteines structure (بنيات البروتينات):
Les protéines (البروتينات) sont des macromolécules de structures constituées de chaînes d'acides aminés liés les uns aux autres grâce aux liaisons peptidiques (liaisons amides = acide + amine).
- On parle souvent de protéines lorsque le nombre d'acides aminés dépasse 100.
- On parle de peptides oligopeptides, polypeptides pour les molécules de moins de 100 acides aminés. Sinon on parle de peptides.
Quels sont les principaux types de protéines ?
Il n'existe pas de norme généralisée concernant la classification
des protéines. Ainsi, ces dernières peuvent être classées en:
- Homoprotéines: protéines homogènes, constituées uniquement de chaînes d'acides aminés protéinogènes.
- Hétéroprotéines: protéines hétérogènes, contenant en plus des chaînes
d'acides aminés, d'autres composantes non protéiques, comme des molécules de sucres (glucides) dans les glycoprotéines,
des lipides dans les lipoprotéines, des acides nucléiques dans les nucléoprotéines.
Il peut également y avoir d'autres protéines hétéroprotéines, comme les protéines qui sont phosphorylées (Phosphoprotéines) car associées à l'acide phosphorique. On distingue aussi les Métalloprotéines qui sont des protéines se liant à des éléments minéraux. Les Chromoprotéines sont des protéines associées à des groupes de couleurs.
Les Hémoprotéines liées à l'hémine, une porphyrine à fer que l'on trouve dans l'Hémoglobine qui est constituée de 4 sous-unités (2 alpha et 2 béta) chacune portant 4 hèmes (= 4 noyaux pyrrole portant chacun une molécule de fer).

Selon la forme générale de la protéine, on peut également être distingué deux principaux types de protéines. Le premier concerne les protéines globulaires et le second concerne les protéines fibreuses.

Comme exemples de protéines fibreuses, on note le collagène et la kératine.
A l'inverse des protéines fibreuses, les protéines globulaires sont caractérisées par une solubilité dans les solutions aqueuses et une capacité à se déplacer et à se propager.
Les enzymes sont des protéines globulaires qui ont des capacités catalytiques.
Les protéines fibreuses sont des éléments structuraux et protecteurs pour l'organisme. À titre d'exemples, on cite la kératine des ongles, des cornes et des sabots, les élastines des muscles et des vaisseaux sanguins, puis le collagène des tendons.
En se basant sur la fonction biologique des protéines, celles ci peuvent également être classées en :
enzymes, protéines structurales, protéines de stockage, protéines de transport, protéines contractiles,
protéines protectrices dans le sang, toxines et hormones.
Les protéines ont quatre structures principales dont:
1/ Structure primaire,
2/ Structure secondaire,
3/ Structure tertiaire et
4/ Structure quaternaire.
STRUCTURE PRIMAIRE DES PROTEINES
Sources: structure primaire des protéines

La structure primaire des protéines reflète la disposition des acides aminés (SEQUENCE) qui marque chaque protéine dépendant des gènes appropriés contenu dans l'ADN
(Acide désoxyribonucléique). Connaître tous les acides aminés composant une protéine revient à faire son hydrolyse complète et réaliser des expériences menant à connaître les extrêmités amine et carboxyle de la protéine.
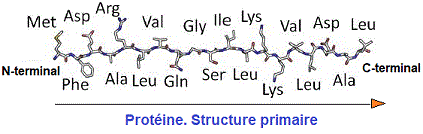
Considérant d'éventuels liens qui peuvent se produire entre les groupes R d’acides aminés éloignés les uns des autres dans une même protéine, celle ci peut avoir différentes structures qui changent la forme de la protéine dans d'autres dimensions. Il en résulte les tructures secondaires, tertiaires et quaternaires.
STRUCTURE SECONDAIRE DES PROTEINES
La structure secondaire d’une protéine est formée par repliement des chaînes peptidiques sous forme d’hélices alpha et de feuillets bêta. Les liaisons hydrogène jouent un rôle important dans la formation de la structure secondaire des protéines.
- Les chaines latérales des AA formant la chaine polypeptidique jouent un rôle important dans l’établissement de la structure secondaire (hydrophobe, hydrophile, charge, encombrement stérique).
- On distingue en général deux types principaux de structure secondaire ordonnée :
- Hélices alpha. Etat hélicoïdal.
- Feuillets béta. Etat étiré.
- Ces structures sont stabilisées par l’établissement de liaisons hydrogènes entre groupe C=O et N-H des liaisons peptidiques.
- Toutes les liaisons peptidiques contribuent au maintien de la structure secondaire.
HELICE ALPHA.
- L’hélice alpha est stabilisée par des liaisons hydrogènes entre les groupes C=O et N-H distants de 4 résidus dans la séquence primaire.
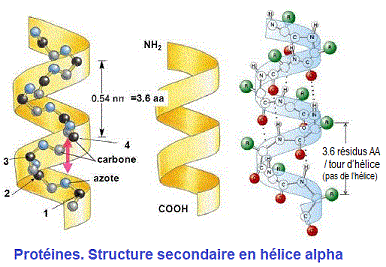
- Le pas de l’hélice α est de 5.4 A° et correspond à la hauteur entre 2 spires et 3.6 rédidus d’acides aminés.
- La période est la distance (27A°) séparant 2 résidus se retrouvant exactement dans la même position, ce qui se produit tous les 18 résidus soit cinq tours de spires.
- La structure en hélice est favorisée par les AA à chaines latérales volumineuses qui sont orientées vers l’extérieur par rapport à l’axe de l’hélice.
- La proline est défavorable à l’hélice α.
Comme exemple de protéines à hélices alpha, on on cite l'hormone insuline, qui est utilisée pour traiter le diabète (Diabète). C'est la première protéine fabriquée grâce aux biotechnologies modernes en 1979 et commercialisé en 1982.
Lien: Insuline 3D
L'insuline est formée de deux chaînes polypeptidiques (51 acides aminés au total). La chaîne A (21 acides aminés) et la chaîne B (30 acides aminés) et reliées entre elles par 2 ponts disulfures et 1 pont disulfure intrachaîne dans la chaîne A.
FEUILLET BETA.
- D’autres protéines ou régions de protéines ont une conformation β qui est une structure en feuillets successifs formant un angle entre eux.
- Cette structure est également stabilisée par des liaisons hydrogènes.
- Le brin β est une structure étirée.
- Les chaines latérales sont situées alternativement au-dessus et en-dessous du plan formé par le squelette peptidique (fig.).
- La période est la distance séparant 2 radicaux situés en cis. Elle est d’environ 7A°.

- Le feuillet plissé β correspond à deux brins β adjacents s’alignant pour former un feuillet.
- Les liaisons hydrogènes entre les groupes CO=NH des 2 brins stabilisent la structure.
- Il existe:
--- Les feuillets β antiparallèles : les chaines peptidiques sont orientées en sens opposé.
--- Les feuillets β parallèles : les chaines peptidiques sont orientées dans le même sens.

- Les feuillets β antiparallèles sont plus stables que les feuillets β parallèles.
- La structure en feuillet β est favorisée par les AA à chaines radicalaires courtes.
- La proline est défavorable à la formation de feuillet β.
COUDES
- En dehors des hélices α ou des feuillets β, des séquences courtes en aa adoptent des structures désordonnées formant des coudes.
- On distingue :
--- Les tours : 2 à 4 aa connectant 2 brins β antiparallèles.
--- Les boucles : en général une dizaine de résidus qui relient des feuillets β, ou un feuillet β et une hélice α. Généralement situées à la surface, les boucles forment des sites d’interactions moléculaires (fixation d’Ag ou un ligand par exemple).
- Les enchainements d’hélices α et /ou de brins β par les tours et les boucles forment des superstructures secondaires.
STRUCTURE TERTIAIRE DES PROTEINES
البنية الثلاثية للبروتين
La structure tertiaire des protéines est constituée de l’assemblage de structures secondaires protéiques (hélices alpha et feuillets bêta) par des forces physiques donnant la forme finale et fonctionnelle des protéines. Les liaisons covalentes (via des ponts -S-S-), les liaisons ioniques (entre les acides aminés basiques les A. aminés acides) et les liaisons hydrophobes jouent un rôle important dans la formation de la structure tertiaire des protéines.
Les protéines contiennent des régions formées d’hélice α, des feuillets β, des régions sous structures rigides (des coudes), des repliements souvent dus à la présence de la proline.
- La structure spatiale complète d’une protéine est sa structure tertiaire (structure tridimensionnelle, structure 3D). La détermination de celle-ci met en jeu des méthodes physiques et plus particulièrement la méthode de diffraction aux rayons X.
- C’est la configuration globale d’une protéine après repliement des régions en hélice α et en feuillet β sur elles mêmes .

- La structure tertiaire d'une protéine est une structure tridimensionnelle (structure 3D), joueant un rôle majeur dans la fonction protéique. A titre d'exemple, nous citons la formation du site actif (active site, موقع نشيط) des enzymes à travers le rapprochement tridimensionnelle de certains acides aminés (distants dans la structure primaire). Le site actif est essentielle pour la catalyse enzymatique. Il permet la liaison du substrat avec l'enzyme avant que le complexe se transforme en produits.

- Les protéines peuvent avoir une structure globulaire (prédominance d’hélice α) ou fibreuse (prédominance de feuillet β).
- En général, les AA à groupement hydrophobe sont localisés à l’intérieur de la molécule, les liaisons hydrophobes participent ainsi de manière importante à la stabilité de la structure.
- Les groupements hydrophiles sont situés à la surface de la molécule.
- Les autres liaisons faibles interviennent également, liaisons hydrogènes et liaisons électrostatiques.
- En général, la structure tertiaire est influencée par 4 types d’interactions (liaisons de faibles énergies).
- Les ponts disulfures stabilisent la structure tertiaire de la protéine.
STRUCTURE QUATERNAIRE DES PROTEINES
البنية الرباعية للبروتين
La structure quaternaire des protéines est constituée suite à l'association de plusieurs sous-unités protéiques pour assurer une fonction précise. Comme exemple de protéines à structure quaternaire, on cite l'hémoglobine, composée de 4 sous unités de types d'alpha (Alpha, a) et bêta (Béta,) en proportion 2 alpha-2 bêta (a 2- b 2). Détail sur la structure de l'Hémoglobine
- L’association-dissociation est un moyen de contrôle de l’activité d'une protéine.
Par exemple, la protéine kinase A dépendante de l’AMP (PKA) est un tétramère inactif ; la fixation de l’AMP, second messager hormonal, sur les sous-unités régulatrices R provoque la dissociation de la structure quaternaire, ce qui démasque et rend actives les sous unités catalytiques C.
- L’interactivité entre sous-unités permet :
--- L’effet coopératif : la fixation d’un substrat par une sous-unité augmente l’affinité des autres sous-unités
pour ce même substrat ;
--- l’effet allostérique : la fixation d’effecteurs (activateurs ou inhibiteurs) sur les sous-unités modifie (+/-) l’affinité de ces sous-unités pour le substrat.
Les structures des protéines (structures tertiaires et quaternaires en particulier) ne sont pas fixes mais changent dans les protéines afin de remplir les différentes fonctions (changements conformationnels).
L'ordinateur joue un rôle important dans l'examen des structures tridimensionnelles des protéines.
QUESTION 36.
A part le carbone et l'hydrogène, l'élément chimique le plus fréquent dans les protéines est: (!Le phosphore)(L'azote)(!Le soufre)
QUESTION 37.
Quels sont les 2 grands groupes de protéines ? (!Globulines et Albumines)(Homoprotéines et Hétéroprotéines)
QUESTION 38.
Les enzymes sont: (Protéines globulaires)(!Protéines fibreuses)
QUESTION 39.
Les hémoprotéines: (!sont des homoprotéines)(sont des protéines liées à une porphyrine à fer)(!sont des nucléoprotéines)
QUESTION 40.
Les protéines globulaires biologiquement actives sont constituées de: (cocher une seule réponse) (! Feuillets 'béta' toujours)(Feuillets 'béta' et hélices 'alpha')
QUESTION 41.
A propos des protéines globulaires et fibreuses: ( les protéines globulaires sont à prédominance d’hélice α)(les protéines fibreuses sont à prédominance de feuillet β)(!le collagène et la kératine sont des protéines globulaires )
QUESTION 42.
La structure des protéines en feuillet béta est déterminée par: -cocher une seule réponse (Les liaisons H entre les groupes C=O et N-H de 2 parties polypéptidiques)(!Les ponts dissulfures de 2 parties polypéptidiques)
QUESTION 43.
La structure des protéines en hélice 'alpha' est déterminée par: (cocher une seule réponse) (! Les ponts dissulfures)(Les liaisons H entre les groupes C=O et N-H)
QUESTION 44.
L’hélice alpha est stabilisée par des liaisons hydrogènes entre les groupes C=O et N-H distants de 4 résidus dans la séquence primaire. (!Faux)(Vrai)
QUESTION 45.
Le feuillet plissé β correspond à: (!Un brin β)(deux brins β adjacents)
QUESTION 46.
A propos des hélices alpha: (est favorisée par les AA à chaines latérales volumineuses qui sont orientées vers l’extérieur par rapport à l’axe de l’hélice.)(!La proline est favorable à la formation des hélices alpha.)
QUESTION 47.
A propos du feuillet β: (!Le feuillet β antiparallèle est moins stables que le feuillet β parallèle.)(La proline est défavorable à la formation de feuillet β.)(La structure en feuillet β est favorisée par les AA à chaines radicalaires courtes)
QUESTION 48.
A propos des structures secondaires en coudes: (Les tours connectant les brins β antiparallèles)(Les boucles relient des feuillets β aux hélices α)(!Les boucles relient les hélices α entre elles.)
QUESTION 49.
Les interactions qui stabilisent la structure quaternaire sont principalement : (Les liaisons hydrogène, les interactions de Van der Waals et les interactions ioniques. )(!Les liaisons covalentes)(!Les liaisons peptidiques )
QUESTION 50.
L'hémoglobine a une structure de type: ( 'alpha 2'-'béta2')(! 'alpha-béta')
QUESTION 51.
Les sous unités des protéines oligomériques sont dissociées en présence: (!de béta-mercaptoéthanol)(en présence de SDS -Sodium Dodecyl Sulfate-)
QUESTION 52.
Les sous unités des protéines oligomériques sont séparées par filtration sur gel en présence d'urée 6 M: (Vrai)(!Faux)
NOTIONS D'ENZYMOLOGIE

Sources: enzymologie

Les enzymes sont des protéines qui sont capable de faire la catalyse biologique (transformer des substrats en des produits).
ATTENTION:
- les ARN des ribosomes peuvent catalyser des réactions. De ce fait, ces types d'ARN catalyseurs sont appelés 'RYBOZYMES'.
- Les ABZYMES (pour ab = antibodies) sont des anticorps qui peuvent fonctionner comme des enzymes. Contrairement aux anticorps classiques, qui se lient à des antigènes spécifiques pour les neutraliser, les abzymes ont la capacité supplémentaire de catalyser des réactions chimiques. Cette double fonctionnalité rend les abzymes uniques et précieuses dans diverses applications médicales et industrielles. Ils peuvent être conçus pour avoir des activités enzymatiques spécifiques, leur permettant d'effectuer des tâches telles que la décomposition des toxines ou des agents pathogènes.
Les enzymes rentrent en contact avec le substrat à travers les acides aminés du 'site actif'. Elles accélèrent les réactions métaboliques d'un organisme vivant.
Groupes d'enzymes selon la structure
Selon leur structure, les enzymes sont divisées en deux groupes :
- Enzyymes simples formées uniquement à partir d’acides aminés, comme de nombreuses enzymes d’hydrolyse.
- Enzymes mixtes ou complexes, composées d'une partie protéique et de parties supplémentaires non protéiques appelées 'groupe prosthétique' ou 'coenzyme', tandis que la partie protéique est appelée 'apoenzyme'. Il convient de rappeler que de nombreuses coenzymes sont constituées de vitamines (vitamine B notamment) et de ribonucléotides modifiés tels que la nicotinamide adénine dinucléotide (NAD) et la flavine adénine dinucléotide (FAD).
Le coenzyme peut exister sous deux états, soit intimement liée à l'enzyme, soit capable d'être dissociée de l'enzyme.
- Dans certains cas, les enzymes incluent des métaux tels que le magnésium (Mg), le fer (Fe), le cuivre (Cu) et d'autres métaux, comme cofacteurs. En cas de chauffage élevé de l'enzyme, la partie protéique est affectée tandis que les cofacteurs restent inchangés.
Comme exemple d'enzymes complexes, citons les peroxydases, qui oxydent de nombreuses substances en présence de peroxyde d'hydrogène (H2O2). Les peroxydases sont constituées d'une partie protéique et d'un groupe non protéique qui comprent un atome de fer (Fe) et appelé Hème, semblable à l'heme de l'émoglobine (qui n'est as une enzyme).
QUESTION 53.
Ribozyme: (!C'est une enzyme qui tranforme l'ARN)(C'est un ARN catalyseur situé au niveau des ribosomes)
QUESTION 54.
Abzyme: (!C'est une enzyme qui tranforme l'ARN)(!C'est un ARN catamyseur situé au niveau des ribosomes)(C'est un anticorps doté d'une activité catalytique)
QUESTION 55.
Les enzymes sont modifiées (ou détruites) après leur action sur le substrat : (Faut)(!Vrai)
QUESTION 56.
Les enzymes sont: (Protéines globulaires)(!Protéines fibreuses)
QUESTION 57.
Le site actif des enzymes est nécessairement spécifique d'un seul substrat: (Vrai)(!Faux)
QUESTION 58.
Le site actif des enzymes est constitué de quelques acides aminés (3 à 4) rapprochés par le repliement de la molécule: (!Faux)(Vrai)
QUESTION 59.
La fixation du substrat sur les acides aminés du site actif des enzymes est réalisée par des liaisons faibles (Vrai)(!Faux )
QUESTION 60.
A propos du coenzyme d'une enzyme
(Peut être la vitamine B) (!peut être un lipide)(!peut être un motif glucidique)
QUESTION 61.
Le seul constituant non thermolabile d'une enzyme mixte est:
(Le coenzyme)(!L'apoenzyme)
QCMs DE CONCOURS
QUESTION (Rabat 2016).
A propos des anticorps:
(Les anticorps sont des protéines glycosylées)(!L'association antigène-anticorps implique des liaisons covalentes)(!Les anticorps sont des acides nucléiques)(L'association antigène-anticorps implique des interactions faibles)
QUESTION (Rabat 2016).
A propos des enzymes:
(!Une enzyme peut avoir plusieurs sites de fixation pour son substrat)(Les enzymes augmentent la vitesse des réactions qu'elles catalysent)(!Une enzyme permet de catalyser plusieurs types de réaction)(Toutes les enzymes sont des protéines)
QUESTION (Rabat 2016).
A propos des acides aminés:
(!La plupart des acides aminés naturels appartiennent à la série D)(!Ils sont tous constitués par une fonction amine primaire au niveau du carbone alpha)(L'assemblage des acides aminés constitue la structure primaire des peptides et des protéines)(!Tous les acides aminés possèdent un carbone asymetrique)
QUESTION (Rabat 2016).
Laquelle -ou lesquelles- des phrases, ci dessous est -ou sont- vraie-s-?:
(! La mélatonine est un acide aminé)(La sérine est un acide aminé polaire)(! L'isoleucine est un acide aminé hétérocyclique)(A pH 7, la chaîne latérale R de la lysine est chargée positivement)
QUESTION (Rabat 2016).
Quelle paire d'acides aminés possède des chaînes latérales chargées négativement à pH 8?:
(Aspartate et glutamate)(!Glutamine et glutamate)(!Histidine et lysine)(!Asparagine et glutamine)
QUESTION (Rabat 2016).
A propos de la structure primaire des protéines:
(!La structure primaire est la composition en acides aminés d'une protéine. C'est à dire, le pourcentage de chacun des 20 acides aminés)(!La séquence primaire décrit l'ordre d'apparition des structures en hélice et feuillet béta et en tournant depuis l'acide aminé N-terminal à l'acide aminé C-terminal)(La structure primaire est la séquence des acides aminés. C'est à dire, l'ordre des acides aminés depuis l'acide aminé N-terminal à l'acide aminé C-terminal)(!La structure primaire est le nombre d'acides aminés dans une protéine)
QUESTION (Rabat 2016).
Lequel -ou lesquels- des agents suivants, peuvent provoquer la dénaturation d'une protéine in vivo?:
(pH 2)(!Froid --20°C-)(! Radiations ultraviolettes -UV-)(!Chaleur 100°C)
QUESTION 76 (Rabat 2022).
Les acides aminés:
(Hormis la glycine, sont des composés chiraux présentant une stéréoisomérie D/L.)(Sont classés en quatre groupes en fonction des propriétés de leur chaîne latérale.)(Protéinogènes, sont des unités de base de construction des protéines.)(!
Aucune des propositions A, B et C n'est juste.)
QUESTION 77 (Rabat 2022).
La structure primaire d'une protéine se rapporte:
(!A la structure tridimensionnelle localement adoptée par certains segments.)(!Au repliement dans l'espace d'une chaîne polypeptidique.)(!A la manière dont sont agencées les différentes chaînes protéiques ou sous-unités.)(A la séquence en acides aminés.)
QUESTION 78 (Rabat 2022).
La biosynthèse d'une protéine fait intervenire:
(L'ARN messager qui se lie au ribosome.)(!Des quadruplets de nucléotides appelés codons.)(L'anticodon d'un ARN de transfert apportant l'acide aminé correspondant.)(!Aucune des propositions A, B et C n'est juste.)
QUESTION 79 (Rabat 2022).
L'enzyme :
(!Est constituée d'acides aminés qui doivent tous rentrer en contact avec le substrat.)(Modifie chimiquement le substrat qui se lie à elle.)(est une protéine qui présente un site actif.)(!un polysaccharide qui présente un site actif.)
QUESTION 80 (Rabat 2022).
Nommer le composé suivant:

(!Alanine)(!Glycine)(L-Leucine.)(!Histidine.)
QUESTION 61 (Casablanca 2024).
Parmi les acides aminés, on identifie les acides aminés :
(!basiques)(Aromatiques.)(par leur radical R.)(!synthétisés exclusivement par l'organisme.)(!ils ont tous une fonction latérale acide.)
QUESTION 62 (Casablanca 2024).
La sérine :
(a un NH2 et un COOH portés par le carbone alpha.)(!est un acide aminé essentiel.)(Comporte une fonction OH au niveau du radical R.)(!est un acide aminé aromatique.)(!n'a pas de rôle structural.)
QUESTION 63 (Casablanca 2024).
L'acide glutamique :(est identifié par la nature de la chaine latérale)(!est un acide aminé essentiel)(!est un acide aminé basique)(!absorbe dans l’U.V.)(!possède un groupement thiol.)
QUESTION 64 (Casablanca 2024).
Les acides aminés essentiels :(sont apportés par l'alimentation.)(!sont d'origine exogène et endogène.)(!sont synthétisés par le foie.)(!sont au nombre de 10.)(!n'ont aucun rôle physiologique.)
QUESTION 65 (Casablanca 2024).
Indiquez la réponse juste concernant la liaison peptidique:(elle associe CO et NH par une liaison amide.)(!elle est stabilisée par des liaisons ioniques.)(!elle s'établit entre deux protéines successives)(!elle est assurée par une liaison hydrogène.)(!elle n'est pas impliquée dans la structure primaire des protéines)
QUESTION 66 (Casablanca 2024).
La structure en feuillet béta des protéines :(!est une structure primaire.)(est stabilisée par des liaisons hydrogène.)(!nécessite des ponts dissulfures.)(!est une structure quaternaire.)(!est stabilisée par des liaisons covalentes.)
QUESTION 67 (Casablanca 2024).
Les protéines sont:(!exclusivement globulaires.)(!constituées d’une seule chaîne peptidique linéaire)(!sont des structures désordonnées)(nécessitent un enchainement d’acides aminés - structure primaire-)(!toutes de type allostérique.)
QUESTION 68 (Casablanca 2024).
L'hémoglobine:(!est constituée d’une sous-unité.)(contient du Fer.)(!inclue 6 noyaux pyrole.)(présente des propriétés de coopérativité.)(a un rôle essentiel dans les échanges gazeux.)
QUESTION 38 (Marrakech 2024).
Quel(s) est (sont) les acide(s) aminé(s) parmi les suivants qui est (sont) basique(s)?:(L'Arginie)(!L'Asparagine)(!La Glutamine)(L'Histidine)(La Lysine)
QUESTION 39 (Marrakech 2024).
Quel(s) est (sont) les acide(s) aminé(s) parmi les suivants qui est (sont) neutre(s)?:(La glycine)(La sérine)(La thréonine)(La leucine)(La valine)
QUESTION 40 (Marrakech 2024).
Parmi les acides aminés essentiels on trouve:(La thréonine)(La leucine)(!La sérine)(Le tryptophane)(L'isoleucine)
QUESTION 41 (Marrakech 2024).
Dans une séquence peptidique:(Les acides aminés sont appelés 'résidus')(!L'acide aminé N-terminal possède un groupement carboxyle libre.)(L'acide aminé C-terminal se trouve en dernier de la chaine.)(!Les acides aminés sont reliés les uns aux autres par des liaisons hydrogène.)(!Les acides aminés sont désignés par leur nom suivi du suffixe 'yl'.)
QUESTION 42 (Marrakech 2024).
Un polypeptide comprend:(!Au moins 2 acides aminés.)(!Au moins 4 acides aminés.)(!4 à 20 acides aminés.)(20 à 100 acides aminés.)(!Au-delà de 100 acides aminés.)
QUESTION 43 (Marrakech 2024).
Dans un peptide l'acide aminé 'C-terminal':(A perdu un hydrogène de sa fonction amine.)(!Est le premier de la chaine peptidique.)(Est le seul qui n'est pas désigné par le suffixe 'yl'.)(Est l'acide aminé qui a sa fonction carboxyl libre.)(!Est l'acide aminé qui a sa fonction amine libre. )
QUESTION 44 (Marrakech 2024).
Soit la séquence suivante d'acides aminés:
'Glu-Phe-Cys-Tyr-Ser-Gly-Val-Leu-His-Glu-Cys-Gly-Met'(La formation d'un pont disulfure au sein de cette séquence est possible.)(!Elle renferme quatre acides aminés aliphatiques.)(Elle renferme trois acides aminés aromatiques.)(Elle renferme un acide aminé basique.)(!Elle ne renferme aucun acide aminé acide. )
QUESTION 45 (Marrakech 2024).
A propos de la même séquence d'acides aminés ci-dessus ('Glu-Phe-Cys-Tyr-Ser-Gly-Val-Leu-His-Glu-Cys-Gly-Met')(Il y'a au moins un acide aminé polaire.)(!Tous les acides aminés sont apolaires.)(!Tous les acides aminés sont polaires.)(Il y'a au moins un acide aminé essentiel.)(!Aucun acide aminé n'est essentiel. )
QUESTION 46 (Marrakech 2024).
Soit la structure ci-contre
Il s'agit de:(!D'un coude béta.)(!D'un feuillet béta parallèle.)(D'un feuillet béta antiparallèle.)(!D'une hélice alpha)(!D'une protéine chaperon. )
QUESTION 47 (Marrakech 2024).
La liaison peptidique:(!Se forme entre deux acides aminés avec perte d'une molécule d'alanine.)(Est stabilisée par mésomérie.)(!La rotation autour de la liaison C-N est possible avec un fort apport en énergie.)(Est plane.)(Est rigide )
QUESTION 20 (Fes 2024).
A propos des acides aminés, choisir la (les) bonne(s) réponse(s):(La molécule B:
représente un acide aminé.)(!L'enchainement des acides aminés est à l'origine de la formation des lipides)(!La phénylalanine, le tryptophane et l'isoleucine sont des acides aminés aromatiques.)(La lysine, la leucine et la thréonine sont des acides aminés essentiels.)(!La cystéine est un acide aminé cyclique. )
QUESTION 27 (Fes 2024).
A propos des protéines, choisir la (les) bonne(s) proposition(s):(Les protéines sont composées d'un enchainement d'acides aminés reliés par des liaisons peptidiques.)(Les principales structures secondaires des protéines sont: hélice alpha, feuillet béta)(La structure tertiaire des protéines représente le repliement tridimensionnel des chaines polypeptidiques dans l'espace.)(Les protéines jouent un rôle fondamental dans de nombreux processus biologiques)(Toutes les réponses précédentes sont justes. )



- INFORMATIONS CONCOURS ---- ANNALES du CONCOURS ---- REVISION GLUCIDES ---- REVISION LIPIDES ---- REVISION PROTEINES ---- REVISION INFORMATION GENETIQUE ----